解答题-原理综合题 容易0.94 引用3 组卷571
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重要贡献。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是___________ (填字母)。
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.铅蓄电池负极是 ,正极是Pb
,正极是Pb
(2)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为: 。
。
①酸式氢氧燃料电池的电解质是酸,其正极的电极反应式为___________ 。
②工作一段时间后,电解质溶液的pH将___________ (填“变大”、“变小”或“不变”)。
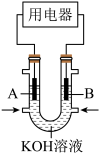
(3)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为:
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为: 。
。___________ (填“A”或“B”)电极入口通甲烷,其电极反应式为___________ 。
(4)某同学欲把反应 设计成原电池,请写出负极的电极反应式:
设计成原电池,请写出负极的电极反应式:___________ 。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.铅蓄电池负极是
(2)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为:
①酸式氢氧燃料电池的电解质是酸,其正极的电极反应式为
②工作一段时间后,电解质溶液的pH将
(3)将
(4)某同学欲把反应
22-23高一下·福建福州·期中
类题推荐
电池是人类生产和生活中的重要能量来源,各式各样电池的发明和应用是化学对人类的一项重要贡献。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是___________(填字母)。
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将___________ 直接转变为电能(填:“化学能”“太阳能”“热能”等),在外电路中电流方向为___________ 。(填:“从a流向b”或“从b流向a”)

(3)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),实验测得电子定向移向A电极,则
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),实验测得电子定向移向A电极,则___________ (填“A”或“B”)电极入口加乙醇,其电极反应式为___________ 。

(4)用原电池装置探究 对
对 与
与 反应生成
反应生成 的影响。
的影响。
①在酸性条件下,该反应的离子方程式为___________ 。
②图中盐桥的作用原理是___________ 。
③上图装置验证增大 ,可提高
,可提高 的氧化性,请补全操作和现象:闭合K,至指针读数稳定后,
的氧化性,请补全操作和现象:闭合K,至指针读数稳定后,___________ 。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是___________(填字母)。
| A.锌锰电池工作一段时间后碳棒会变细 |
| B.氢氧燃料电池可将化学能直接转变为电能 |
| C.太阳能电池的主要材料是高纯度的二氧化硅 |
| D.铅蓄电池负极是 |

(3)将

(4)用原电池装置探究
①在酸性条件下,该反应的离子方程式为
②图中盐桥的作用原理是
③上图装置验证增大
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重要贡献。
(1)原电池的设计原理与某一类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
(2)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是___________ (填字母)。
A.锌锰干电池工作一段时间后正极碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.太阳能电池的主要材料是高纯度的二氧化硅
D.铅蓄电池负极是 ,正极是
,正极是
E.原电池的负极金属的活动性一定比正极金属的活动性强
F.原电池工作时,阳离子向正极移动,阴离子向负极移动
(3)根据氧化还原反应: 设计原电池,若用铜、银做两个电极,开始两电极质量相等,当电路中转移
设计原电池,若用铜、银做两个电极,开始两电极质量相等,当电路中转移 电子时两电极的质量差为
电子时两电极的质量差为___________ g。
(4)航天技术上使用的氢氧燃料电池具有高能,轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为: 。
。
①酸式氢氧燃料电池的电解质是硫酸,其正极的电极反应式为___________ 。
②酸式氢氧燃料电池,工作一段时间后,电解质溶液的 将
将_______ (填“变大”、“变小”或“不变”)。
(5)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压,电池总反应式为: ,负极为
,负极为___________ ,放电时,溶液中 向
向___________ (填“正”或“负”)极移动。
(1)原电池的设计原理与某一类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
| A. |
| B. |
| C. |
| D. |
A.锌锰干电池工作一段时间后正极碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.太阳能电池的主要材料是高纯度的二氧化硅
D.铅蓄电池负极是
E.原电池的负极金属的活动性一定比正极金属的活动性强
F.原电池工作时,阳离子向正极移动,阴离子向负极移动
(3)根据氧化还原反应:
(4)航天技术上使用的氢氧燃料电池具有高能,轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为:
①酸式氢氧燃料电池的电解质是硫酸,其正极的电极反应式为
②酸式氢氧燃料电池,工作一段时间后,电解质溶液的
(5)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压,电池总反应式为:
电池是人类生产和生活中的重要能量来源。人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。
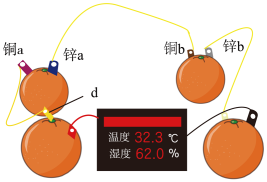
(1)知识源于实践。学习原电池知识后,某学习小组以 和
和 为电极材料,制作了如图所示的水果电池(水果果汁中含游离的
为电极材料,制作了如图所示的水果电池(水果果汁中含游离的 )。该组电池放电时,下列说法正确的是_______(填字母)。
)。该组电池放电时,下列说法正确的是_______(填字母)。
(2)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是_______(填字母)。
(3)将 设计成燃料电池,共利用率更高,装置如图所示(
设计成燃料电池,共利用率更高,装置如图所示( 、
、 为多孔碳棒)
为多孔碳棒)
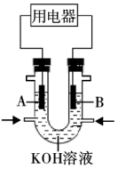
实验测得电子定向移向 电极,则
电极,则_______ (填“ ”或“
”或“ ”)电极入口通甲烷,其电极反应式为
”)电极入口通甲烷,其电极反应式为_______ 。
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为: ,请回答下列问题:
,请回答下列问题:
①放电时,正极反应式为_______ 。
②放电时,负极附近溶液的碱性_______ 。(填“增强”或“减弱”)
(5) 与
与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图:
组合形成的质子交换膜燃料电池的结构示意图如图:
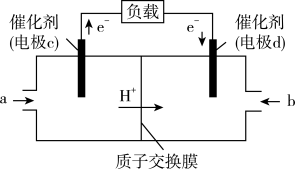
电池总反应为 ,则
,则 电极反应式为
电极反应式为_______ ,若线路中转移 电子,则上述
电子,则上述 燃料电池,消耗的
燃料电池,消耗的 的质量为
的质量为_______  。
。
(1)知识源于实践。学习原电池知识后,某学习小组以

| A.每个水果果汁中的 |
| B.锌 |
| C.四个水果电池串联,则电极 |
| D.铜 |
| A.锌锰电池工作一段时间后碳棒会变细 |
| B.氢氧燃料电池具有高效的特点,能量转化率可达100% |
| C.太阳能电池的主要材料是高纯度的二氧化硅 |
| D.铅蓄电池负极是 |

实验测得电子定向移向
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:
①放电时,正极反应式为
②放电时,负极附近溶液的碱性
(5)

电池总反应为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


