填空题 适中0.65 引用2 组卷352
硫是重要的非金属元素,也是人类较早认识的化学元素之一。人们对硫元素的利用,其本质就是通过各种化学反应,实现含硫元素的物质之间的转化。
(1)硫可以形成分子式为 、
、 、
、 、
、 的单质,其中
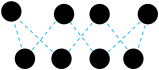
的单质,其中 的分子球棍模型如图所示。下列有关说法正确的是_______。
的分子球棍模型如图所示。下列有关说法正确的是_______。
(2)将 气体通入
气体通入 溶液中,没有看到明显现象,再遇入一种气体(或加入一种物质)后,可产生一种沉淀,该气体(或物质)不可能是_______。
溶液中,没有看到明显现象,再遇入一种气体(或加入一种物质)后,可产生一种沉淀,该气体(或物质)不可能是_______。
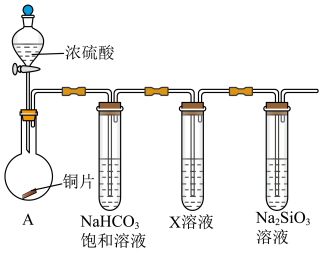
(3)用如图所示实验装置(部分夹持仪器已略去)探究铜丝与过量浓硫酸的反应。
下列实验或说法不合理的是_______。
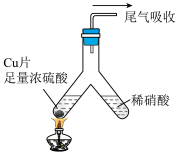
(4)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是_______ 。不采用铜跟浓硫酸反应来制取硫酸铜的原因是_______ 。
(5)在 溶液中滴加少量
溶液中滴加少量 溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目
溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目_______ 。
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(6)中华人民共和国国家标准(G2762022)规定葡萄酒中 最大使用量为0.25 g⋅L-1,取300.00 mL葡萄酒,通过适当的方法使所含
最大使用量为0.25 g⋅L-1,取300.00 mL葡萄酒,通过适当的方法使所含 全部逸出并用
全部逸出并用 将其全部氧化为
将其全部氧化为 ,消耗浓度为0.0900 mol•L-1NaOH标准溶液25mL,该葡萄酒中
,消耗浓度为0.0900 mol•L-1NaOH标准溶液25mL,该葡萄酒中 含量为
含量为_______ g·L-1。
(7)同学们继续设计实验探究亚硫酸与次氯酸的酸性强弱:甲同学查阅资料得知 为难溶于水的白色沉淀,因此设计了实验方案为:将
为难溶于水的白色沉淀,因此设计了实验方案为:将 通入漂白粉溶液中,若观察到有白色沉淀生成,说明发生反应
通入漂白粉溶液中,若观察到有白色沉淀生成,说明发生反应
 ,则证明亚硫酸性强于次氯酸。乙同学分为甲同学方案的反应原理是错误的,理由是
,则证明亚硫酸性强于次氯酸。乙同学分为甲同学方案的反应原理是错误的,理由是_______ 。
(1)硫可以形成分子式为

| A.1 mol |
| B. |
| C.硫的单质在足量的空气中完全燃烧可生成 |
| D. |
| A. | B. | C. | D. |

下列实验或说法不合理的是_______。
| A.上下移动①中铜丝可控制 |
| B.②中品红溶液是验证 |
| C.③中石蕊溶液先变红后褪色 |
| D.为确认 |
(5)在
_______
(6)中华人民共和国国家标准(G2762022)规定葡萄酒中
(7)同学们继续设计实验探究亚硫酸与次氯酸的酸性强弱:甲同学查阅资料得知
22-23高一下·上海宝山·期中
类题推荐
葡萄酒的酿造:葡萄酒是由葡萄汁发酵而成的。在酿造葡萄酒的过程中面临两大问题:一是在葡萄汁发酵过程中产生的杂菌会影响葡萄酒的酿造和保存;二是葡萄酒中所含的还原性物质一旦被氧化,葡萄酒的果香味就会消失,影响口感。在酿酒实践中,人们发现二氧化硫可以解决这两大问题。某同学拟设计实验探究SO2能解决以上问题的原因。
(1)“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是

(2)将 SO2气体通入 BaCl2溶液中,没有看到明显现象,再通入一种气体(或加入一种物质)后,可产生一种沉淀,该气体(或物质)不可能是
(3)实验室一般用亚硫酸钠固体和质量分数为 70%左右的浓硫酸反应,反应的化学方程式为_______ ,不选择稀硫酸的原因是_______ 。
(4)二氧化硫的水溶液能导电,有同学据此认为SO2是电解质,谈谈你的看法_____ ;该水溶液放置一段时间后,pH减小,此过程发生反应的离子方程式为____ 。
(5)中华人民共和国国家标准(G2762022)规定葡萄酒中 SO2最大使用量为 0.25g·L−1, 取 300.00mL 葡萄酒,通过适当的方法使所含 SO2全部逸出并用 H2O2将其全部氧化为 H2SO4, 消耗浓度为 0.0900mol·L-1NaOH 标准溶液 25mL,该葡萄酒中 SO2含量为_______ g·L−1。
(1)“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是

| A.加热时,①中白色固体从下部转移到上部 |
| B.加热时,②中溶液从红色变浅至几乎无色,冷却后又恢复红色 |
| C.加热时,③中溶液变红,冷却后溶液红色褪去 |
| D.三个“封管实验”中所发生的化学反应都是可逆反应 |
| A.Cl2 | B.NH3 | C.CO2 | D.H2S |
(4)二氧化硫的水溶液能导电,有同学据此认为SO2是电解质,谈谈你的看法
(5)中华人民共和国国家标准(G2762022)规定葡萄酒中 SO2最大使用量为 0.25g·L−1, 取 300.00mL 葡萄酒,通过适当的方法使所含 SO2全部逸出并用 H2O2将其全部氧化为 H2SO4, 消耗浓度为 0.0900mol·L-1NaOH 标准溶液 25mL,该葡萄酒中 SO2含量为
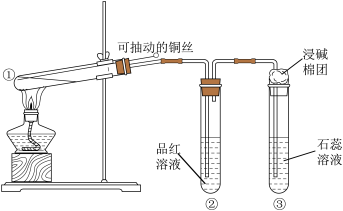
I.实验室可用如图装置(略去部分夹持仪器)制取SO2并验证其性质。
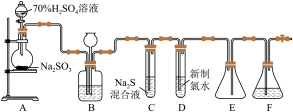
(1)盛装70% H2SO4溶液的仪器名称为___________ 。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________ (填代号)。
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________ 。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案中能达到实验目的的是方案___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为___________ 。
(5)装置E的作用是___________ 。装置F中为___________ 溶液。
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量如下表
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和___________ (填“氧化剂”或“抗氧化剂”)。
II.利用下图所示装置进行铜与硝酸反应的实验,得到的实验现象如下表:
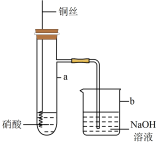
(7)组装好装置后进行实验之前需先进行___________ 。
(8)写出实验Ⅰ中产生的无色气体化学式___________ 。
(9)写出实验Ⅱ中铜与浓硝酸反应的离子方程式___________ 。
(10)装置中采用可拉动铜丝的优点是___________ (写一点)。
(11)针对Ⅰ中溶液呈蓝色,Ⅱ中溶液呈绿色。甲同学推测溶液的颜色与硝酸铜的质量分数有关,而乙同学推测Ⅱ中溶液呈绿色的原因是NO2在硝酸铜溶液中达到饱和所致。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是___________。

(1)盛装70% H2SO4溶液的仪器名称为
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案中能达到实验目的的是方案
(5)装置E的作用是
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量如下表
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g•kg-1 | 0.25g•kg-1 | 1g•kg-1 |
II.利用下图所示装置进行铜与硝酸反应的实验,得到的实验现象如下表:

| 序号 | 实验试剂(20℃) | 实验现象 |
| Ⅰ | 铜丝、2mL稀硝酸 | 铜丝逐渐变细,有气泡产生,a中先产生无色气体后略有红棕色,溶液变蓝 |
| Ⅱ | 铜丝、2mL浓硝酸 | 反应剧烈,铜丝逐渐变细,a中上方出现红棕色气体,溶液变绿 |
(8)写出实验Ⅰ中产生的无色气体化学式
(9)写出实验Ⅱ中铜与浓硝酸反应的离子方程式
(10)装置中采用可拉动铜丝的优点是
(11)针对Ⅰ中溶液呈蓝色,Ⅱ中溶液呈绿色。甲同学推测溶液的颜色与硝酸铜的质量分数有关,而乙同学推测Ⅱ中溶液呈绿色的原因是NO2在硝酸铜溶液中达到饱和所致。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是___________。
| A.加热绿色溶液,观察颜色变化 |
| B.加水稀释绿色溶液,观察颜色变化 |
| C.向绿色溶液中通入氮气,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网