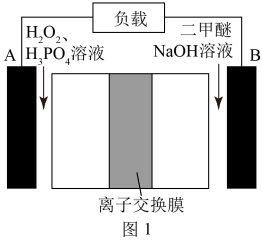
单选题 适中0.65 引用5 组卷330
二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g) CH3COOCH3(g)△H1<0
CH3COOCH3(g)△H1<0
反应Ⅱ:CH3COOCH3(g)+2H2(g) CH3CH2OH(g)+CH3OH(g)△H2<0
CH3CH2OH(g)+CH3OH(g)△H2<0
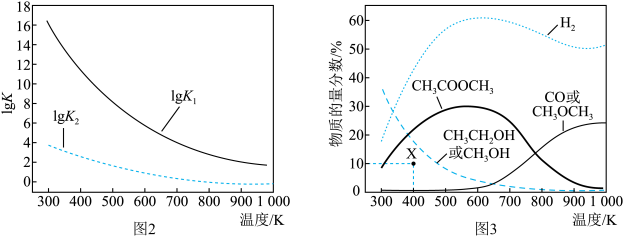
在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是
反应Ⅰ:CO(g)+CH3OCH3(g)
反应Ⅱ:CH3COOCH3(g)+2H2(g)
在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是

| A.曲线 B 表示 H2的物质的量分数随温度的变化 |
| B.600 K 后升高温度,CH3COOCH3的物质的量分数降低原因是反应Ⅱ平衡右移 |
| C.测得 X 点 CH3CH2OH 的物质的量分数是 10%,则 X 点反应Ⅱ有:v 正>v 逆 |
| D.其他条件不变,延长反应时间能提高平衡混合物中乙醇含量 |
22-23高二下·江苏连云港·期中
类题推荐
二甲醚催化制备乙醇主要涉及以下两个反应:
反应I:CO(g)+CH3OCH3(g)=CH3COOCH3(g)
反应II:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)
固定CO、CH3OCH3、H2的起始原料比为1∶1∶2、体系压强不变的条件下发生反应I、II,平衡时部分物质的物质的量分数随温度变化如图所示。下列说法不正确 的是

反应I:CO(g)+CH3OCH3(g)=CH3COOCH3(g)
反应II:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)
固定CO、CH3OCH3、H2的起始原料比为1∶1∶2、体系压强不变的条件下发生反应I、II,平衡时部分物质的物质的量分数随温度变化如图所示。下列说法

| A.反应II为放热反应 |
| B.由图可知,600K以后随温度的升高,氢气物质的量减少 |
| C.曲线C也可以表示CH3OH的物质的量分数 |
| D.由500K上升至600K,温度对反应I的影响大于对反应II的影响 |
二甲醚催化制备乙醇主要涉及以下两个反应:
反应I:CO(g)+CH3OCH3(g) CH3COOCH3(g)+akJ·mol-1
CH3COOCH3(g)+akJ·mol-1
反应Ⅱ:CH3COOCH3(g)+2H2(g) CH3CH2OH(g)+CH3OH(g)+bkJ·mol-1
CH3CH2OH(g)+CH3OH(g)+bkJ·mol-1
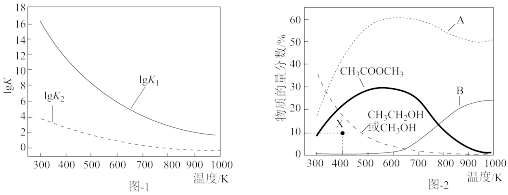
反应I、Ⅱ的平衡常数的对数lgK1、1gK2与温度的关系如图-1所示:固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应I、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图-2所示。下列说法正确的是
反应I:CO(g)+CH3OCH3(g)
反应Ⅱ:CH3COOCH3(g)+2H2(g)
反应I、Ⅱ的平衡常数的对数lgK1、1gK2与温度的关系如图-1所示:固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应I、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图-2所示。下列说法正确的是

| A.a<0 |
| B.测得X点CH3CH2OH的物质的量分数是10%,则X点反应II有:V正<V逆 |
| C.由CH3COOCH3的曲线知,600K后升高温度对反应I的影响程度大于反应II |
| D.曲线B表示H2的物质的量分数随温度的变化 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网