填空题 适中0.65 引用5 组卷408
某研究小组同学用活性炭还原处理氮氧化物,向 恒容密闭容器中加入足量C与
恒容密闭容器中加入足量C与 发生反应,
发生反应, 。在不同实验条件下,平衡时
。在不同实验条件下,平衡时 与温度T的关系如图所示:
与温度T的关系如图所示:
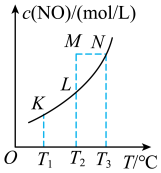
(1)结合图中数据,判断该反应的
___________ 0(填“>”或“<”),理由是___________ 。
(2)K、L、M、N四点对应的平衡常数分别为 、
、 、
、 、
、 ,判断其大小关系
,判断其大小关系_____ 。
使用氢能源可以减少汽车尾气中氮氧化合物的排放。利用甲醇与水蒸气反应可以制备氢气: ,该反应过程中的能量变化如图:
,该反应过程中的能量变化如图:

(3)
___________ 0(填“>”“=”或“<”),途径(I)的活化能
___________ 。
(4)途径(I)变为途径(II):改变的条件是___________ ,反应热
___________ (填“增大”“减小”或“不变”)。
(5)下列有关活化分子的说法正确的是___________。

(1)结合图中数据,判断该反应的
(2)K、L、M、N四点对应的平衡常数分别为
使用氢能源可以减少汽车尾气中氮氧化合物的排放。利用甲醇与水蒸气反应可以制备氢气:

(3)
(4)途径(I)变为途径(II):改变的条件是
(5)下列有关活化分子的说法正确的是___________。
| A.增大反应物浓度可以提高活化分子百分数 |
| B.增大体系的压强一定能提高活化分子百分数 |
| C.使用合适的催化剂可以增大活化分子的能量 |
| D.升高温度能提高活化分子百分数 |
22-23高二下·上海黄浦·期中
类题推荐
合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中ad表示物质吸附在催化剂表面时的状态) 的
的
_______  ,对总反应速率影响较大步骤的化学方程式为
,对总反应速率影响较大步骤的化学方程式为_______ 。
【小题2】若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是_______。
起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如下图。
_______  (选填“>”“<”或“=”);理由是
(选填“>”“<”或“=”);理由是_______ 。
【小题4】该反应从开始到平衡时生成氨气的平均速率:
_______  ;反应的平衡常数:B点
;反应的平衡常数:B点_______ D点。(选填“>”“<”或“=”)
【小题5】C点 的转化率为
的转化率为_______ 。
【小题6】在恒温恒容密闭容器中,下列能判断合成氨的反应达到化学平衡时,下列说法正确的是_______。

【小题2】若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是_______。
| A.升高温度,使单位体积内活化分子百分数增加 |
| B.增加反应物的浓度,使单位体积内活化分子百分数增加 |
| C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加 |
| D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加 |
起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如下图。
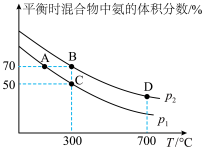
【小题4】该反应从开始到平衡时生成氨气的平均速率:
【小题5】C点
【小题6】在恒温恒容密闭容器中,下列能判断合成氨的反应达到化学平衡时,下列说法正确的是_______。
| A.正反应速率和逆反应速率相等且为零 | B.氮气和氢气的转化率相等 |
| C.氮气的转化率达到最大值 | D. |
通过化学的方法实现 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径。
减排途径。
Ⅰ.利用酸性水溶液电解池在铂电极上捕集 制储氢物质
制储氢物质 。
。
(1) 被
被___________ (填“氧化”或“还原”)为 ,该铂电极为
,该铂电极为___________ 极。
(2)写出该铂电极的电极方程式___________ 。
(3)当电路中转移 电子时,理论上可生成
电子时,理论上可生成
___________ g。
Ⅱ.利用 制备CO
制备CO
一定温度下,在恒容密闭容器中投入一定量 和
和 进行反应:
进行反应:

(4)在恒定温度与容积下,可以提高 平衡转化率的措施有___________。
平衡转化率的措施有___________。
(5)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得氢气转化率随温度变化如图所示。下列说法错误的是___________。
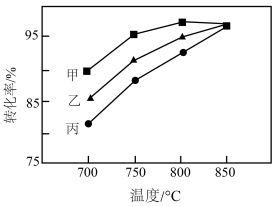
(6)恒容密闭容器中发生上述反应,在投料比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度T(B)
平衡转化率如图所示。则B和D两点的温度T(B)___________ T(D)(填“<”、“>”或“=”),其原因是___________ 。

Ⅲ.利用制备甲醇
一定条件下,向恒容密闭容器中通入一定量和 ,实际可能发生以下两个反应:
,实际可能发生以下两个反应:
主反应:

副反应:

(7)其他条件相同,不同压强下,平衡时 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。

①压强
___________  (填“<”或“>”)。
(填“<”或“>”)。
②如图中温度高于 时,两条曲线重叠的原因是:
时,两条曲线重叠的原因是:___________ 。
Ⅰ.利用酸性水溶液电解池在铂电极上捕集
(1)
(2)写出该铂电极的电极方程式
(3)当电路中转移
Ⅱ.利用
一定温度下,在恒容密闭容器中投入一定量
(4)在恒定温度与容积下,可以提高
| A.向反应容器中充入 | B.向反应容器中充入 |
| C.添加更有效的催化剂 | D.利用合适试剂干燥混合气体 |
(5)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得氢气转化率随温度变化如图所示。下列说法错误的是___________。

| A.850℃下,该时间段内甲、乙、丙可能均达到平衡 |
| B.700℃下,甲对应的活化能最大 |
| C.一般催化剂既能降低活化能,又能降低过渡态的能量 |
| D.其它条件一定时,随着温度升高,单位体积内活化分子数占比增大 |
(6)恒容密闭容器中发生上述反应,在投料比

Ⅲ.利用制备甲醇
一定条件下,向恒容密闭容器中通入一定量和
主反应:
副反应:
(7)其他条件相同,不同压强下,平衡时

①压强
②如图中温度高于
H2S的吸收与利用有多种形式,根据下列研究回答:
Ⅰ.干法脱硫: ;
;
 ;
;
(1)空气氧化脱除H2S反应: 的
的
_______ kJ·mol-1。
Ⅱ.H2S高温裂解反应:
(2)不同温度下,具有一定能量的分子百分数与分子能量的关系如图1所示,E表示某温度下分子的平均能量,Ec是活化分子具有的最低能量,阴影部分的面积反映活化分子的百分数,则图中T1_______ T2(填“>”、“=”或“<”)。
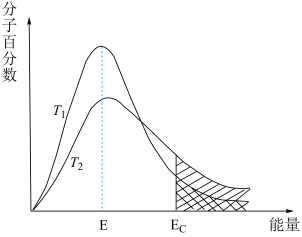
图1
(3)若T1温度下使用催化剂,请在图1中画出相应的活化分子百分数变化_______ 。
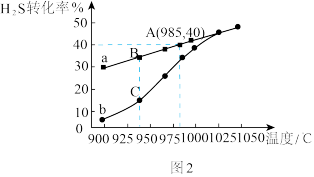
(4)在恒容密闭真空容器中,充入H2S进行高温裂解反应,初始时容器内压强为p,反应温度为900℃。实验过程中控制不同温度,测得H2S的转化率如图2所示,其中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。下列说法正确的是_______。
(5)A的压力转化率表示为: (
( 为A初始压强,
为A初始压强, 为A某时刻分压)。维持温度和压强不变,一定量的H2S分解达到平衡时,用各组分的平衡分压(即组分的物质的量分数×总压)表示的平衡常数
为A某时刻分压)。维持温度和压强不变,一定量的H2S分解达到平衡时,用各组分的平衡分压(即组分的物质的量分数×总压)表示的平衡常数 ,则平衡时H2S的压力转化率
,则平衡时H2S的压力转化率
_______ 。
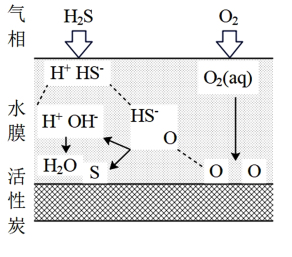
(6)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用下图表示。其它条件不变时,增大气相压强和水膜pH均能提高H2S的去除率,其可能的原因是_______ 。
Ⅰ.干法脱硫:
(1)空气氧化脱除H2S反应:
Ⅱ.H2S高温裂解反应:
(2)不同温度下,具有一定能量的分子百分数与分子能量的关系如图1所示,E表示某温度下分子的平均能量,Ec是活化分子具有的最低能量,阴影部分的面积反映活化分子的百分数,则图中T1

图1
(3)若T1温度下使用催化剂,请在图1中画出相应的活化分子百分数变化
(4)在恒容密闭真空容器中,充入H2S进行高温裂解反应,初始时容器内压强为p,反应温度为900℃。实验过程中控制不同温度,测得H2S的转化率如图2所示,其中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。下列说法正确的是_______。

| A.分别达到A、B、C点时,反应时间为: |
| B.A点时容器内压强为1.2p |
| C.B点H2S的分解速率大于C点 |
| D.高温时a、b两曲线重合的原因是温度升高反应速率加快 |
(5)A的压力转化率表示为:
(6)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用下图表示。其它条件不变时,增大气相压强和水膜pH均能提高H2S的去除率,其可能的原因是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


