解答题-原理综合题 较难0.4 引用2 组卷420
氢能是一种极具发展潜力的清洁能源。
I.水煤气法制取氢气
煤气化装置中发生反应①:C(s)+H2O(g) CO(g)+H2(g) △H=+135kJ•mol-1;
CO(g)+H2(g) △H=+135kJ•mol-1;
水气变换装置中发生反应②:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1。
CO2(g)+H2(g) △H=-41kJ•mol-1。
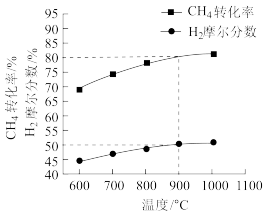
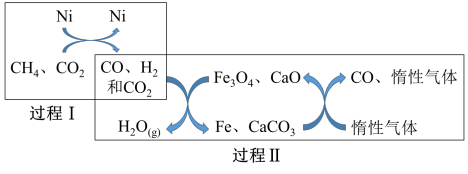
(1)反应①发生前,需要通入一定量的氧气与碳发生燃烧反应,通入氧气的作用为_____ 。其他条件不变时,在相同时间内,向水气变换装置中投入一定量的CaO,H2的体积分数_____ (填“增大”“减小”或“不变”);如图所示,微米CaO和纳米CaO对平衡的影响力不同的原因为_____ 。

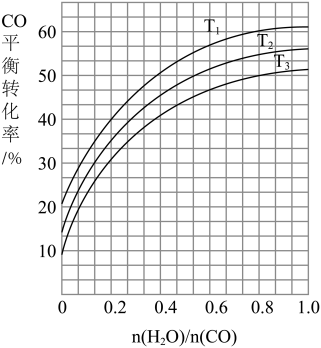
(2)一定量的煤和水蒸气经反应①后进入反应②装置且进料比 =0.8,反应一段时间后,达到平衡时
=0.8,反应一段时间后,达到平衡时 =3:1,CO的平衡转化率为
=3:1,CO的平衡转化率为_____ 。
II.水分解法制取氢气
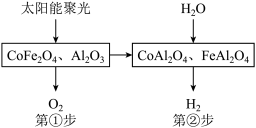
(3)将CoFe2O4负载在Al2O3上作为催化剂,反应分两步实现,产氧温度在1200℃,产氢温度在1000℃时,循环机理如图所示。
已知:H2O(g) H2(g)+
H2(g)+ O2(g) △H=(a+b)kJ•mol-1
O2(g) △H=(a+b)kJ•mol-1
第①步:CoFe2O4(s)+3Al2O3(s) CoAl2O4(s)+FeAl2O4(s)+
CoAl2O4(s)+FeAl2O4(s)+ O2(g) △H=akJ•mol-1;
O2(g) △H=akJ•mol-1;
第②步反应的热化学方程式为______ 。
(4)若第②步反应的平衡常数为K,则平衡常数的表达式为K=_____ 。
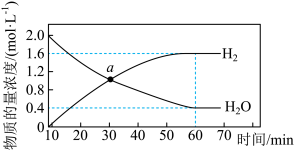
(5)已知对于反应aA(g)+bB(g) cC(g)+dD(g),v正=k正•ca(A)•cb(B),v逆=k逆•cc(C)•cd(D),其中k正、k逆分别为正、逆反应速率常数。1000℃时,第②步反应测得H2O(g)和H2物质的量浓度随时间的变化如图所示,a点时,v正:v逆=
cC(g)+dD(g),v正=k正•ca(A)•cb(B),v逆=k逆•cc(C)•cd(D),其中k正、k逆分别为正、逆反应速率常数。1000℃时,第②步反应测得H2O(g)和H2物质的量浓度随时间的变化如图所示,a点时,v正:v逆=_____ 。
I.水煤气法制取氢气
煤气化装置中发生反应①:C(s)+H2O(g)
水气变换装置中发生反应②:CO(g)+H2O(g)
(1)反应①发生前,需要通入一定量的氧气与碳发生燃烧反应,通入氧气的作用为

(2)一定量的煤和水蒸气经反应①后进入反应②装置且进料比
II.水分解法制取氢气
(3)将CoFe2O4负载在Al2O3上作为催化剂,反应分两步实现,产氧温度在1200℃,产氢温度在1000℃时,循环机理如图所示。

已知:H2O(g)
第①步:CoFe2O4(s)+3Al2O3(s)
第②步反应的热化学方程式为
(4)若第②步反应的平衡常数为K,则平衡常数的表达式为K=
(5)已知对于反应aA(g)+bB(g)

2023·全国·模拟预测
类题推荐
绿色能源是未来能源发展的重要方向,氢能是重要的绿色能源。
(1)氢气是一种环保的气体,不会污染大气且热值高。相关化学键的键能表示如表:
已知:H2O(g)=H2O(l)△H=-dkJ/mol,则氢气燃烧热的△H1=____ kJ/mol(用含a.、b、c、d的代数式表示)。
(2)催化制氢是目前大规模制取氢气的方法之一:CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.2kJ·mol-1;在T1℃时,将0.10molCO(g)与0.40molH2O(g)充入5L的容器中,反应平衡后H2的物质的量分数x(H2)=0.08。
CO2(g)+H2(g) △H2=-41.2kJ·mol-1;在T1℃时,将0.10molCO(g)与0.40molH2O(g)充入5L的容器中,反应平衡后H2的物质的量分数x(H2)=0.08。
①CO的平衡转化率α=____ %,反应平衡常数K=____ (结果保留2位有效数字)。
②保持容器容积不变,在反应初期,可以提高单位时间内CO转化率的措施有____ (填标号)。
A.增大水蒸气的浓度
B.通入“惰性气体”
C.升高温度
D.按原料起始比再通入0.10molCO(g)与0.40molH2O(g)
③由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系可用如图1表示。当升高到某一温度时,反应重新达到平衡后,相应的点分别为____ (填标号)。

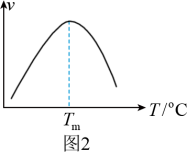
④研究表明,CO催化变换反应的速率方程为v=k[x(CO)·x(H2O)- ]式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图2所示。温度升高时,CO催化变换反应的Kp
]式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图2所示。温度升高时,CO催化变换反应的Kp____ (填“增大”或“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是____ 。
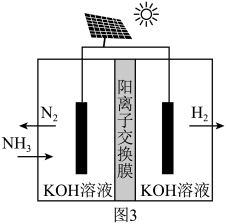
(3)氨电解法制氢气。利用电解原理,将氨转化为高纯氢气,其装置如图3所示。阳极的电极反应式为____ 。
(1)氢气是一种环保的气体,不会污染大气且热值高。相关化学键的键能表示如表:
| 化学键 | O=O | H—H | O—H |
| 键能E/(kJ·mol-1) | a | b | c |
已知:H2O(g)=H2O(l)△H=-dkJ/mol,则氢气燃烧热的△H1=
(2)催化制氢是目前大规模制取氢气的方法之一:CO(g)+H2O(g)
①CO的平衡转化率α=
②保持容器容积不变,在反应初期,可以提高单位时间内CO转化率的措施有
A.增大水蒸气的浓度
B.通入“惰性气体”
C.升高温度
D.按原料起始比再通入0.10molCO(g)与0.40molH2O(g)
③由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系可用如图1表示。当升高到某一温度时,反应重新达到平衡后,相应的点分别为

④研究表明,CO催化变换反应的速率方程为v=k[x(CO)·x(H2O)-

(3)氨电解法制氢气。利用电解原理,将氨转化为高纯氢气,其装置如图3所示。阳极的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网