解答题-原理综合题 较难0.4 引用3 组卷527
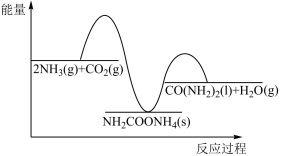
尿素[CO(NH2)2]在医学、农业、工业以及环保领域都有着广泛的应用。工业合成尿素的热化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(l) ∆H=-87.0kJ•mol-1。合成尿素的反应分步进行,如图是反应的机理及能量变化(单位:kJ•mol-1),TS表示过渡态。
CO(NH2)2(g)+H2O(l) ∆H=-87.0kJ•mol-1。合成尿素的反应分步进行,如图是反应的机理及能量变化(单位:kJ•mol-1),TS表示过渡态。
(1)若∆E1=66.5kJ•mol-1,则∆E2=_____ kJ•mol-1。
(2)若向某恒温、恒容的密闭容器中分别加入等物质的量的NH3和CO2,发生合成尿素的反应。下列叙述能说明反应已经达到平衡状态的是_____ (填标号)。
a.断裂6molN-H键的同时断裂2molO-H键
b.混合气体的压强不再变化
c.混合气体的密度不再变化
d.CO2的体积分数不再变化
(3)最后一步反应的化学方程式可表示为:HNCO(g)+NH3(g) CO(NH2)2(g)。
CO(NH2)2(g)。
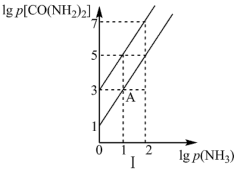
I.在T1℃和T2℃时,向恒容密闭容器中投入等物质的量的HNCO和NH3,平衡时lgp(NH3)与lgp[CO(NH2)2]的关系如图I所示,p为物质的分压(单位为kPa)。_____ T2(填“>”“<”或“=”)。
②T2时,该反应的标准平衡常数Kθ=_____ 。
[已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g) gG(g),Kθ=
gG(g),Kθ= ,其中Kθ=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压。]
,其中Kθ=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压。]
③保持温度不变,点A时继续投入等物质的量的两种反应物,再次达到平衡时,CO(NH2)2的体积分数将_____ (填“增大”“减小”或“不变”)。
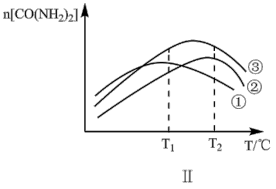
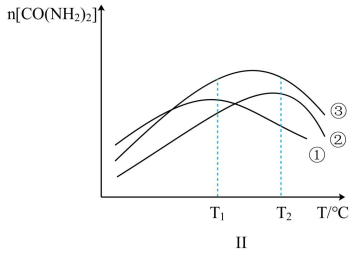
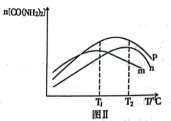
Ⅱ.其他条件相同,在不同催化剂下发生该反应,反应正向进行至相同时间,容器中CO(NH2)2的物质的量随温度变化的曲线如图Ⅱ所示。_____ (填标号)。
⑤500℃以上,n[CO(NH2)2]下降的原因可能是_____ (不考虑物质的稳定性)。
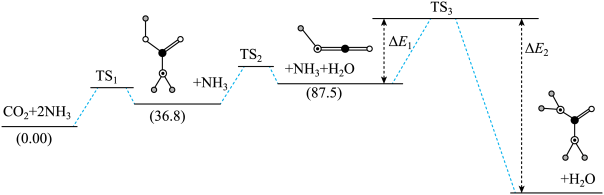
(1)若∆E1=66.5kJ•mol-1,则∆E2=
(2)若向某恒温、恒容的密闭容器中分别加入等物质的量的NH3和CO2,发生合成尿素的反应。下列叙述能说明反应已经达到平衡状态的是
a.断裂6molN-H键的同时断裂2molO-H键
b.混合气体的压强不再变化
c.混合气体的密度不再变化
d.CO2的体积分数不再变化
(3)最后一步反应的化学方程式可表示为:HNCO(g)+NH3(g)
I.在T1℃和T2℃时,向恒容密闭容器中投入等物质的量的HNCO和NH3,平衡时lgp(NH3)与lgp[CO(NH2)2]的关系如图I所示,p为物质的分压(单位为kPa)。
②T2时,该反应的标准平衡常数Kθ=
[已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g)
③保持温度不变,点A时继续投入等物质的量的两种反应物,再次达到平衡时,CO(NH2)2的体积分数将
Ⅱ.其他条件相同,在不同催化剂下发生该反应,反应正向进行至相同时间,容器中CO(NH2)2的物质的量随温度变化的曲线如图Ⅱ所示。

⑤500℃以上,n[CO(NH2)2]下降的原因可能是
22-23高三下·辽宁锦州·阶段练习
类题推荐
党的二十大报告提出未来我国将用更高的标准深入打好污染物防治攻坚战,统筹减污降碳,所以深入研究碳、氮元素的物质转化有着重要的实际意义,工业上合成尿素的反应:2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(l) ΔH
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2⇌NH2COONH4(s)ΔH1
NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g)ΔH2
其能量变化曲线如图所示,则ΔH、ΔH1和ΔH2由大到小的顺序为_______ 。
(2)若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是_______(填标号)。
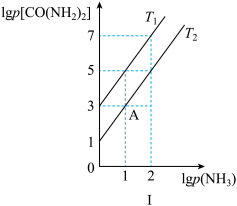
(3)在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的两种反应物,发生以下反应:HN=C=O(g)+NH3(g)⇌CO(NH2)2(g) ΔH<0,平衡时lg p(NH3)与lg p[CO(NH2)2]的关系如图Ⅰ所示,p为物质的分压强(单位为kPa)。
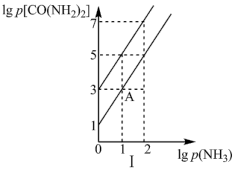
①若v正=k正×p(HNCO)×p(NH3),v逆=k逆×p[CO(NH2)2]。T1℃时, =
=_______ kPa-1。
②T2℃时此反应的标准平衡常数Kθ=_______ 。(对于反应:dD(g)+eE(g)⇌gG(g), ,其中pθ=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压。)
,其中pθ=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压。)
③若点A时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数_______ (填“变大”“变小”或“不变”)。
④图Ⅱ为在不同催化剂下,反应至相同时间容器中尿素的物质的量随温度变化的曲线,则在T1℃,催化效率最好的是催化剂_______ (填序号)。T2℃以上,n[CO(NH2)2]下降的原因可能是_______ (答出一点即可,不考虑物质的稳定性)。
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2⇌NH2COONH4(s)ΔH1
NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g)ΔH2
其能量变化曲线如图所示,则ΔH、ΔH1和ΔH2由大到小的顺序为

(2)若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是_______(填标号)。
| A.断裂6mol N-H键的同时断裂2mol O-H键 |
| B.压强不再变化 |
| C.混合气体的密度不再变化 |
| D.CO2的体积分数不再变化 |

①若v正=k正×p(HNCO)×p(NH3),v逆=k逆×p[CO(NH2)2]。T1℃时,
②T2℃时此反应的标准平衡常数Kθ=
③若点A时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数
④图Ⅱ为在不同催化剂下,反应至相同时间容器中尿素的物质的量随温度变化的曲线,则在T1℃,催化效率最好的是催化剂

党的二十大报告提出,未来我国将用更高的标准统筹减污降碳,所以深入研究碳氨元素的物质转化有着重要的实际意义,工业上合成尿素的反应:
 。
。
已知合成尿素的反应分两步进行:
①

②

回答下列问题:
(1)总反应的ΔH=_____ kJ·mol-1,ΔS_______ 0 (填“>”或“<”)。已知活化能Ea1远小于Ea2,某科研小组模拟工业合成尿素生产,发现反应温度在140℃时生成尿素的反应速率反而比80℃小,可能原因是___________ 。
(2)一定温度下,若向某恒容密闭容器中加入等物质的量的NH3和CO2,发生上述总反应。下列叙述不能说明总反应已经达到平衡状态的是________(填标号)。
(3)工业合成尿素中,通常氨气、二氧化碳投料比大于2,请分析可能原因______ (填标号)。
A.氨易获得,成本较低
B.氨过剩可提高二氧化碳的转化率,加快合成速率
C.氨结合水,促进反应②正向移动
(4)在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的两种反应物,发生以下反应:
 ,平衡时lg p(NH3)与lg p[CO(NH2)2]的关系如图Ⅰ所示,p为物质的分压强(单位为kPa)。
,平衡时lg p(NH3)与lg p[CO(NH2)2]的关系如图Ⅰ所示,p为物质的分压强(单位为kPa)。
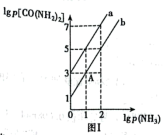
①若 ,
, 。T1℃对应的平衡曲线是
。T1℃对应的平衡曲线是______ (填“a”或“b”),此时
____ kPa-1。
②若点A 时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数________ (填“变大”“变小”或“不变”)。
③图Ⅱ为在不同催化剂下,反应至相同时间容器中尿素的物质的量随温度变化的曲线,则在T1℃催化效率最好的是催化剂________ (填序号)。T2℃以上,n[CO(NH2)2]下降的原因可能是___________ (答出一点即可,不考虑物质的稳定性)。
已知合成尿素的反应分两步进行:
①
②
回答下列问题:
(1)总反应的ΔH=
(2)一定温度下,若向某恒容密闭容器中加入等物质的量的NH3和CO2,发生上述总反应。下列叙述不能说明总反应已经达到平衡状态的是________(填标号)。
| A.断裂 6mol N—H 键的同时断裂 2mol O—H 键 | B.压强不再变化 |
| C.混合气体的密度不再变化 | D.CO2体积分数不再变化 |
(3)工业合成尿素中,通常氨气、二氧化碳投料比大于2,请分析可能原因
A.氨易获得,成本较低
B.氨过剩可提高二氧化碳的转化率,加快合成速率
C.氨结合水,促进反应②正向移动
(4)在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的两种反应物,发生以下反应:

①若
②若点A 时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数
③图Ⅱ为在不同催化剂下,反应至相同时间容器中尿素的物质的量随温度变化的曲线,则在T1℃催化效率最好的是催化剂

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网