解答题-原理综合题 适中0.65 引用2 组卷445
减少NOx、CO2的排放,实现资源化利用是化学工作者研究的重要课题。
(1)尿素水解生成的NH3催化还原NO是重要的烟气脱硝技术,且为可逆过程。反应过程与能量关系如图1,在以Fe2O3为主的催化剂表面可能发生的反应过程如图2。
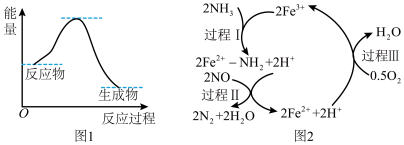
①NH3催化还原NO为_______ (填“放热”“吸热”)反应。
②上述脱硝的总反应化学方程式为:_______ 。
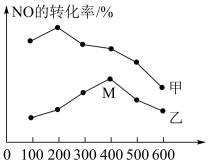
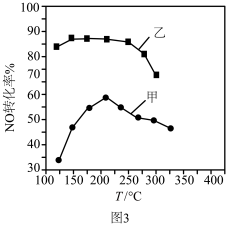
(2)电厂烟气脱氮的反应为:4NH3(g) + 6NO(g) 5N2(g) + 6H2O(g) ΔH<0,现向某2 L密闭容器中分别投入一定量的NH3、NO发生以上反应,其他条件相同时,在甲、乙两种催化剂的作用下,相同时间内NO的转化率与温度的关系如图3。工业上应选择催化剂
5N2(g) + 6H2O(g) ΔH<0,现向某2 L密闭容器中分别投入一定量的NH3、NO发生以上反应,其他条件相同时,在甲、乙两种催化剂的作用下,相同时间内NO的转化率与温度的关系如图3。工业上应选择催化剂_______ (填“甲”或“乙”)。在催化剂甲的作用下,温度高于210°C时,NO转化率降低的可能原因是_______ 。
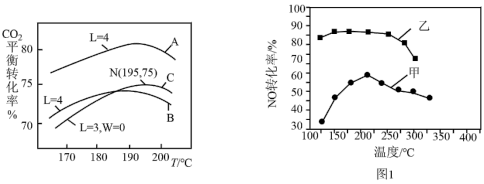
(3)工业以NH3和CO2为原料合成尿素。液相中,合成尿素的热化学方程式为:2NH3(l) + CO2(l) H2O(l) + NH2CONH2(l) ΔH<0,在液相中,CO2的平衡转化率与温度、初始氨碳比(用L表示,L=
H2O(l) + NH2CONH2(l) ΔH<0,在液相中,CO2的平衡转化率与温度、初始氨碳比(用L表示,L= )、初始水碳比(用W表示,W=
)、初始水碳比(用W表示,W= )关系如图4。
)关系如图4。
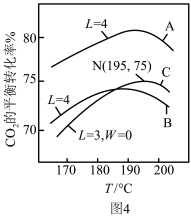
①曲线A、B中,_______ (填“A”或“B”)的W较小。
②对于液相反应,常用某组分M达到平衡时的物质的量分数x(M)代替平衡浓度来计算平衡常数(记作Kx)。195°C时,2NH3(l) + CO2(l) H2O(l) + NH2CONH2(l)的Kx的值为
H2O(l) + NH2CONH2(l)的Kx的值为_______ 。
(4)氨气可以用于燃料电池,其原理是氨气与氧气在碱性条件下反应生成一种常见的无毒气体和水,负极的电极反应式是_______ 。
(1)尿素水解生成的NH3催化还原NO是重要的烟气脱硝技术,且为可逆过程。反应过程与能量关系如图1,在以Fe2O3为主的催化剂表面可能发生的反应过程如图2。

①NH3催化还原NO为
②上述脱硝的总反应化学方程式为:
(2)电厂烟气脱氮的反应为:4NH3(g) + 6NO(g)

(3)工业以NH3和CO2为原料合成尿素。液相中,合成尿素的热化学方程式为:2NH3(l) + CO2(l)

①曲线A、B中,
②对于液相反应,常用某组分M达到平衡时的物质的量分数x(M)代替平衡浓度来计算平衡常数(记作Kx)。195°C时,2NH3(l) + CO2(l)
(4)氨气可以用于燃料电池,其原理是氨气与氧气在碱性条件下反应生成一种常见的无毒气体和水,负极的电极反应式是
2023·北京门头沟·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网