解答题-实验探究题 适中0.65 引用5 组卷539
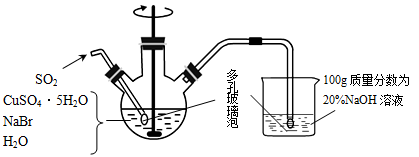
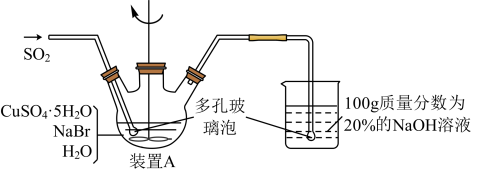
溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末,常用作有机反应的催化剂。实验室制备CuBr的实验步骤和装置如图。

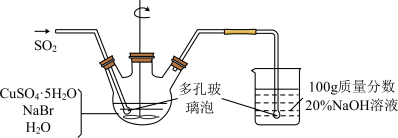
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去蒸馏水中的_______ (写化学式); 三颈烧瓶中反应生成CuBr的离子方程式为_______ ;控制反应在60℃进行,实验中可采取的措施是 _______ ;说明反应已完成的现象是 _______ 。
(2)步骤②抽滤需要避光的原因是_______ ,步骤③依次用溶有少量SO2的水、溶有少量SO2的乙醇、极易挥发的乙醚洗涤,洗涤剂需“溶有SO2”的原因是_______ ;最后用乙醚的目的可能是_______ 。
(3)将产品在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。本实验产品的产率是_______ (保留小数点后1位)。
(4)欲利用上述装置烧杯中的吸收液(经检测主要含有Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。完善下列步骤:①在烧杯中继续通入SO2至恰好反应完全;②向烧杯中加入_______ g 20% NaOH;③加入少量维生素C溶液作抗氧化剂;④通过蒸发浓缩、_______ 、过滤、用乙醇洗涤2~3次;⑤置于真空干燥箱中干燥。


(1)实验所用蒸馏水需经煮沸,煮沸目的是除去蒸馏水中的
(2)步骤②抽滤需要避光的原因是
(3)将产品在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。本实验产品的产率是
(4)欲利用上述装置烧杯中的吸收液(经检测主要含有Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。完善下列步骤:①在烧杯中继续通入SO2至恰好反应完全;②向烧杯中加入
2023·上海长宁·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网