解答题-原理综合题 适中0.65 引用1 组卷792
汽车尾气的氮氧化物是大气污染物的主要来源,研究汽车尾气处理是环境保护的重要课题。试回答下列问题:
(1)有关汽车尾气的生成
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则3NO(g)=N2O(g)+NO2(g) ΔH=_____ 。
(2)用CO消除汽车尾气
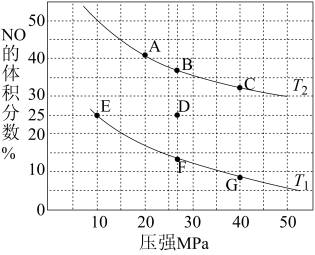
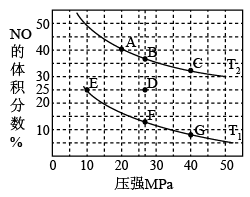
在催化剂a作用下将尾气转化为无污染的气体而除去。向密闭容器中充入10molCO(g)和8molNO(g)发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。
N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。
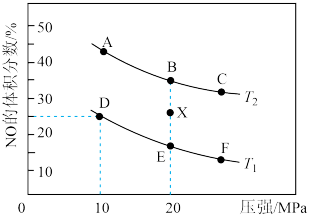
①已知T2>T1,则反应ΔH______ 0(填“>”、“=”或“<”)。
②该反应达到平衡后,为了同时提高反应速率和NO的平衡转化率,可采取的措施______ (填字母序号)。
a.改用高效催化剂
b.恒温恒容条件下,按投料比增大反应物浓度
c.移去CO2
d.升高温度
e.缩小反应容器的体积
③在温度为T1、容器体积为4L的条件下,反应进行到10min时恰好在D点达到平衡。则从反应开始到平衡时,NO平均反应速率v(NO)=_____ ;若其他条件不变,升高温度,用分压表示的平衡常数Kp_____ (填“变大”、“变小”或“不变”)。
④在X点,对反应容器升温的同时扩大体积使体系压强减小,重新达到平衡状态可能为图中_____ 点(填A~F)。
(3)用NH3消除汽车尾气
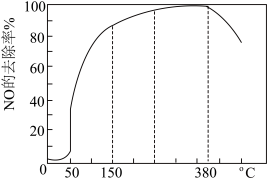
新型催化剂b在含有少量O2条件下,能催化NH3,和NOx,反应生成N2,且高温下活性很强。在盛有催化剂b的管式反应容器[如图(一)]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图(二)所示。
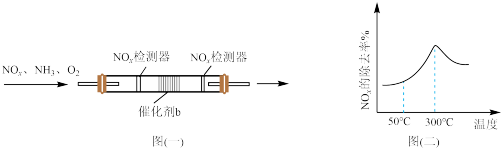
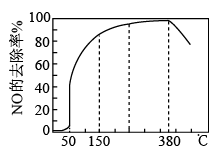
①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是_____ 。
②当温度高于300℃时,NOx除去率迅速下降的原因是_____ 。
(1)有关汽车尾气的生成
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则3NO(g)=N2O(g)+NO2(g) ΔH=
(2)用CO消除汽车尾气
在催化剂a作用下将尾气转化为无污染的气体而除去。向密闭容器中充入10molCO(g)和8molNO(g)发生反应2NO(g)+2CO(g)

①已知T2>T1,则反应ΔH
②该反应达到平衡后,为了同时提高反应速率和NO的平衡转化率,可采取的措施
a.改用高效催化剂
b.恒温恒容条件下,按投料比增大反应物浓度
c.移去CO2
d.升高温度
e.缩小反应容器的体积
③在温度为T1、容器体积为4L的条件下,反应进行到10min时恰好在D点达到平衡。则从反应开始到平衡时,NO平均反应速率v(NO)=
④在X点,对反应容器升温的同时扩大体积使体系压强减小,重新达到平衡状态可能为图中
(3)用NH3消除汽车尾气
新型催化剂b在含有少量O2条件下,能催化NH3,和NOx,反应生成N2,且高温下活性很强。在盛有催化剂b的管式反应容器[如图(一)]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图(二)所示。

①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是
②当温度高于300℃时,NOx除去率迅速下降的原因是
2023·四川成都·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 N2(g)+2CO2(g),
N2(g)+2CO2(g),