解答题-原理综合题 较易0.85 引用4 组卷276
根据所学化学知识,回答下列问题。
I.太阳能可以给我们提供能源,现在以太阳能为热源,经铁氧化物循环分解液态水的过程如图所示。
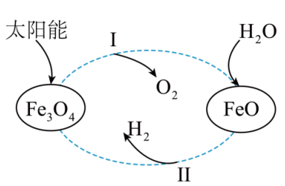
已知:①2H2(g)+O2(g)=2H2O(g)
②

(1)请写出过程I的热化学方程式___________
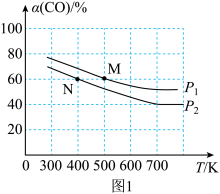
II.为了实现碳达峰、碳中和,工业利用 合成乙烯,反应原理为:
合成乙烯,反应原理为:

(2)已知温度对 的平衡转化率和催化效率的影响如图:
的平衡转化率和催化效率的影响如图:
①由图可知:该反应为反应___________ (填“放热”或“吸热”)。M、N两点对应的平衡常数:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②在总压为 的恒压条件下,M点的投料比为n(H2):n(CO2)=3:1,达到平衡时乙烯的体积分数为
的恒压条件下,M点的投料比为n(H2):n(CO2)=3:1,达到平衡时乙烯的体积分数为___________ 。用平衡分压代替平衡浓度可以得到平衡常数 ,则M点对应温度下的
,则M点对应温度下的
___________ (只需列出有具体数字的计算式,不要求计算出结果)。
③结合图像分析,工业上将该反应温度定于250℃的原因:___________
(3)已知反应的正反应速率可表示为 ,逆反应速率可表示为
,逆反应速率可表示为 ,其中
,其中 、
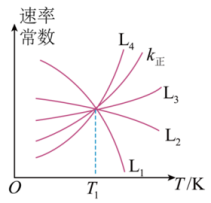
、 为速率常数。如图中能够代表
为速率常数。如图中能够代表 的曲线为
的曲线为___________ (填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
(4)利用惰性电极电解 同样可以制得乙烯,原理如图:
同样可以制得乙烯,原理如图:
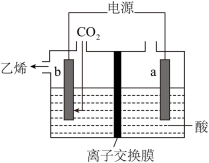
b极的电极反应式为___________
I.太阳能可以给我们提供能源,现在以太阳能为热源,经铁氧化物循环分解液态水的过程如图所示。

已知:①2H2(g)+O2(g)=2H2O(g)
②
(1)请写出过程I的热化学方程式
II.为了实现碳达峰、碳中和,工业利用
(2)已知温度对

①由图可知:该反应为反应
②在总压为
③结合图像分析,工业上将该反应温度定于250℃的原因:
(3)已知反应的正反应速率可表示为

(4)利用惰性电极电解

b极的电极反应式为
22-23高二·重庆渝中·期末
类题推荐
我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应如下:
I.C(s)+H2O(g) CO(g)+H2(g) K1
CO(g)+H2(g) K1
II.CO2(g)+H2(g) CO(g)+H2O(g) K2
CO(g)+H2O(g) K2
III.CaCO3(s) CaO(s)+CO2(g) K3
CaO(s)+CO2(g) K3
IV.C(s)+O2(g) CO2(g) K4
CO2(g) K4
该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),该反应的平衡常数K=
CaCO3(s)+2H2(g),该反应的平衡常数K=___ (用K1等的代数式表示)。
(2)N2O(g)+CO(g) N2(g)+CO2(g)的速率方程为v正=k正c(CO)•c(N2O),v逆=k逆c(CO2)•c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。净反应速率(△v)等于正、逆反应速率之差。平衡时,Δv(500K)
N2(g)+CO2(g)的速率方程为v正=k正c(CO)•c(N2O),v逆=k逆c(CO2)•c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。净反应速率(△v)等于正、逆反应速率之差。平衡时,Δv(500K)___ (填“>”、“<”或“=”) Δv(550K)。
(3)一定条件下,CO2与H2反应可合成CH2=CH2,2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g),该反应分两步进行:
CH2=CH2(g)+4H2O(g),该反应分两步进行:
i.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
ii.2CO(g)+4H2(g) CH2=CH2(g)+2H2O(g) ΔH2
CH2=CH2(g)+2H2O(g) ΔH2
T℃,压强恒定为100kPa时,将n(CO2):n(H2)=1:3的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
CO2的平衡转化率为___ ,反应i的平衡常数Kp=__ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
(4)利用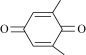 (Q)与
(Q)与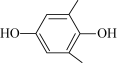 (QH2)电解转化法从烟气中分离CO2的原理如图。已知气体可选择性通过膜电极,溶液不能通过。
(QH2)电解转化法从烟气中分离CO2的原理如图。已知气体可选择性通过膜电极,溶液不能通过。
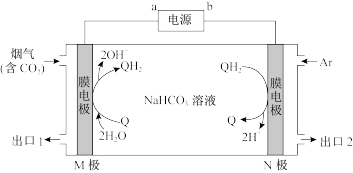
①(填“a”或“b”)___ 为电源负极。
②CO2从出口___ (填“1”或“2”)排出,CO2在M极上发生的反应为___ 。
(1)以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应如下:
I.C(s)+H2O(g)
II.CO2(g)+H2(g)
III.CaCO3(s)
IV.C(s)+O2(g)
该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
(2)N2O(g)+CO(g)
(3)一定条件下,CO2与H2反应可合成CH2=CH2,2CO2(g)+6H2(g)
i.CO2(g)+H2(g)
ii.2CO(g)+4H2(g)
T℃,压强恒定为100kPa时,将n(CO2):n(H2)=1:3的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
| 组分 | H2 | CO | CH2=CH2 |
| 物质的量分数(%) |
(4)利用
 (Q)与
(Q)与 (QH2)电解转化法从烟气中分离CO2的原理如图。已知气体可选择性通过膜电极,溶液不能通过。
(QH2)电解转化法从烟气中分离CO2的原理如图。已知气体可选择性通过膜电极,溶液不能通过。
①(填“a”或“b”)
②CO2从出口
我国力争于2030年前做到碳达峰,2060年前实现碳中和。利用CO2与H2合成有机燃料CH2=CH2是研究热点之一、该反应体系主要涉及以下反应:
①CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1 副反应
②2CO(g)+4H2(g)⇌CH2=CH2(g)+2H2O(g) △H2 副反应
③2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H3 主反应
(1)根据盖斯定律,反应③的△H3=___________ (用△H1和△H2的代数式表示)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
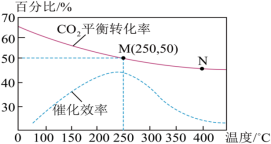
(3)一定条件下,将1molCO2和3molH2加入1L容积不变的密闭容器中,只发生主反应 (不考虑发生副反应),温度对CO2的平衡转化率、实际转化率和催化剂催化效率的影响如图甲所示。
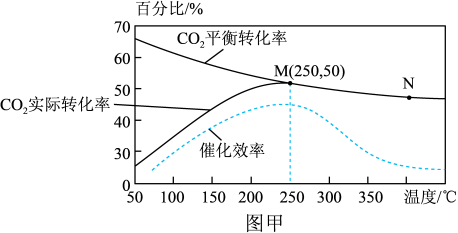
①结合图象分析该反应实际反应温度定于250℃的原因:___________ 。
②实验测得v正=k正c2(CO2)c6(H2),v逆=k逆c(C2H4)·c4(H2O),k正、k逆为速率常数,只与温度有关,250℃时 =
=________ (写出代数式即可);当温度升高时,k正增大m倍,k逆增大n倍,则m_________ n(填“>”、“<”或“=”)。
③设KX为物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。250℃时,该反应达到平衡时的平衡常数KX=________ (写出代数式即可)。
(4)科学家通过电化学方法,用惰性电极进行电解,可有效实现以CO2和水为原料在酸性条件下合成乙烯,其合成原理如图乙所示:
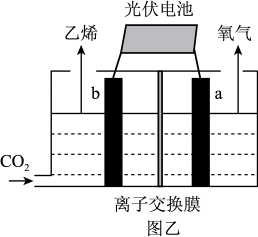
b电极上的电极反应式为________ ,该装置中使用的是_______ (“阴”或“阳”)离子交换膜。
①CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1 副反应
②2CO(g)+4H2(g)⇌CH2=CH2(g)+2H2O(g) △H2 副反应
③2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H3 主反应
(1)根据盖斯定律,反应③的△H3=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO2与H2的浓度,反应①、②、③的正反应速率都增加 |
| B.降低反应温度,反应①、②、③的正、逆反应速率都减小 |
| C.加入催化剂,可提高CO2的平衡转化率 |
| D.及时分离出CH2=CH2(g),反应②、③的平衡均向右移动 |

①结合图象分析该反应实际反应温度定于250℃的原因:
②实验测得v正=k正c2(CO2)c6(H2),v逆=k逆c(C2H4)·c4(H2O),k正、k逆为速率常数,只与温度有关,250℃时
③设KX为物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。250℃时,该反应达到平衡时的平衡常数KX=
(4)科学家通过电化学方法,用惰性电极进行电解,可有效实现以CO2和水为原料在酸性条件下合成乙烯,其合成原理如图乙所示:

b电极上的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网