解答题-工业流程题 较难0.4 引用1 组卷187
大力发展新能源汽车产业是我国兑现碳中和承诺的重要战略之一。随着这一产业的发展,如何处理废旧锂电池成为一个亟需解决的问题。某废弃的钴酸锂( )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:

已知: 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的 ,
, 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。
(1)操作①的名称为______ ;由此可推测,氧化铝______ (填“能”或“不能”)溶于氢氧化钠溶液。
(2)溶液②中所含主要溶质为LiCl、 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)______ 。
(3)将溶液中的 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是__________________ 。
(4)为证明操作④获得的 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入______ ,若无白色沉淀生成,则证明沉淀洗涤干净。
(5)取3.66 g (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为______ (填化学式);在956℃条件下反应完全后,剩余固体相对最开始反应前失重59%,此时固体成分的化学式为 ,
,
______ 。
(6)某同学设计如图装置测定 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是______ (填选项)。

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以______ 离子形态存在,应加入______ 后再进行后续操作。
(8) 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为______ (填选项)。
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为______ 。

已知:
(1)操作①的名称为
(2)溶液②中所含主要溶质为LiCl、
(3)将溶液中的
(4)为证明操作④获得的
(5)取3.66 g
(6)某同学设计如图装置测定

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以
(8)
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为
22-23高一上·山东青岛·开学考试
类题推荐
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为___________ (用元素符号表示)
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是___________
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。
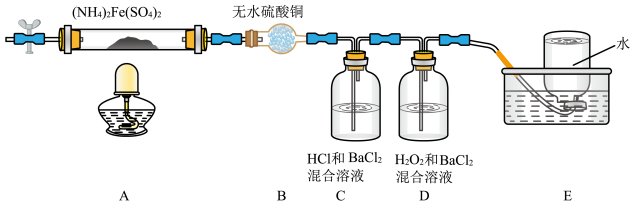
(4)B装置的作用是___________
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式___________ ;若去掉C,是否能得出同样结论,并解释其原因___________ 。
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:___________ 。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解; ②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | ___________ | 固体残留物仅为Fe2O3 |
工业上以红土镍矿(主要成分Mg3Si2O5(OH)4、Fe2MgO4、NiO、FeO、Fe2O3)为原料,采用硫酸铵焙烧法选择性提取镍及其化合物,并回收副产物黄铵铁矾。工艺流程如下图所示:
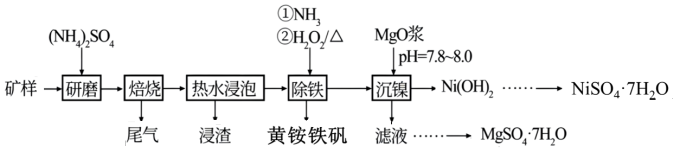
已知:
①在焙烧过程中Mg3Si2O5(OH)4和Fe2MgO4转化为(NH4)2Mg2(SO4)3、(NH4)3Fe(SO4)3及SiO2 ;
②加热情况下,Fe3+可水解生成一种难溶于水的黄色固体FeO(OH);
③常温下,NiSO4易溶于水,NiOOH不溶于水。
(1)在该工艺流程中为了加快化学反应速率而采取的主要措施有_______ (至少回答两项)
(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与(NH4)2SO4反应生成Fe2(SO4)3,该反应的化学方程式为_______ ,“浸渣"的主要成分除铁的氧化物外还有_______ (填化学式)。
(3)“除铁”和“沉镍"时需将Fe3+、Ni2+转化为沉淀。已知溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
若“沉镍"时pH调为7.8,则滤液中Ni2+浓度约为_______ mol/L。
(4)流程中由Ni(OH)2沉淀得到NiSO4·7H2O晶体的操作是_______ ;NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式是_______ 。
(5)依据下列实验和数据可确定黄铵铁矾【化学式可表示为(NH4)xFey(SO4)z(OH)m,摩尔质量为480g/mol】的化学式。
①称取黄铵铁矾2.400 g,加入足量NaOH溶液充分反应后过滤,向滤液中加入足量盐酸酸化,再加入足量的BaCl2溶液,得到沉淀2.330 g。
②Mim Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3和H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。
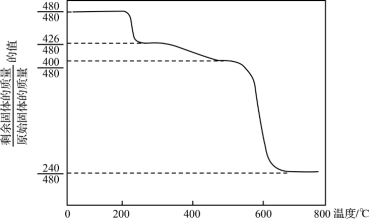
根据以上实验及图中数据确定黄铵铁矾的化学式_______ 。

已知:
①在焙烧过程中Mg3Si2O5(OH)4和Fe2MgO4转化为(NH4)2Mg2(SO4)3、(NH4)3Fe(SO4)3及SiO2 ;
②加热情况下,Fe3+可水解生成一种难溶于水的黄色固体FeO(OH);
③常温下,NiSO4易溶于水,NiOOH不溶于水。
(1)在该工艺流程中为了加快化学反应速率而采取的主要措施有
(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与(NH4)2SO4反应生成Fe2(SO4)3,该反应的化学方程式为
(3)“除铁”和“沉镍"时需将Fe3+、Ni2+转化为沉淀。已知溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 沉淀物 | 黄铵铁矾 | Fe(OH)3 | Ni(OH)2 |
| 开始沉淀时的pH | 1.3 | 2.7 | 7.1 |
| 沉淀完全(c=1×10-5 mol/L)时的pH | 2.3 | 3.7 | 9.2 |
若“沉镍"时pH调为7.8,则滤液中Ni2+浓度约为
(4)流程中由Ni(OH)2沉淀得到NiSO4·7H2O晶体的操作是
(5)依据下列实验和数据可确定黄铵铁矾【化学式可表示为(NH4)xFey(SO4)z(OH)m,摩尔质量为480g/mol】的化学式。
①称取黄铵铁矾2.400 g,加入足量NaOH溶液充分反应后过滤,向滤液中加入足量盐酸酸化,再加入足量的BaCl2溶液,得到沉淀2.330 g。
②Mim Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3和H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。

根据以上实验及图中数据确定黄铵铁矾的化学式
具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
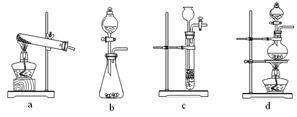
(1)草酸(H2C2O4)分解的化学方程式 为:________________________ ,
下列装置中,可用于草酸分解制取气体的是_______ 。(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成分),实验装置如下图所示,请回答:
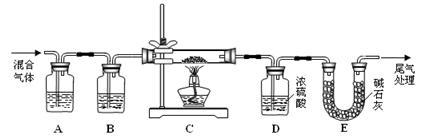
① 为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是_______ 、______ 。
② 在点燃酒精灯之前应进行的操作是:(a)_____ ;(b)通入混合气体一段时间。
③ 准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃 管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____ (假定Fe和H2O 不发生反应,实验过程中每步均完全吸收或反应)。
④ 在本实验中,下列情况会使测定结果n偏大的是_______ (填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
① 请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂 的用量可选择0.5g、0g)
② 若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案___________ 。
(1)草酸(H2C2O4)分解的化学方程式 为:
下列装置中,可用于草酸分解制取气体的是

(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成分),实验装置如下图所示,请回答:

① 为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是
② 在点燃酒精灯之前应进行的操作是:(a)
③ 准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃 管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =
④ 在本实验中,下列情况会使测定结果n偏大的是
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
① 请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂 的用量可选择0.5g、0g)
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | C/mol·l-1 | |
| KMnO4 | H2C2O4 | ||||
| ① | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| ③ | 323 | 0.5 | 0.01 | 0.1 | |
| ④ | 探究催化剂对反应速率的影响 | 0.1 | |||
② 若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


