解答题-实验探究题 较难0.4 引用3 组卷183
用清洁能源代替目前使用最广泛的化石能源可以有效地降低碳排放。现阶段比较成熟的技术有燃料电池、锂电池等。
目前最理想的燃料电池燃料是氢气,某兴趣小组总结了一些制备氢气的方法:
以酸溶液为原料:如
(1)以水(或中性水溶液)为原料:
①水的光分解
②Mg与热水缓慢反应:
③ 与焦炭在高温下生成两种可燃性气体,请写书该反应的化学方程式
与焦炭在高温下生成两种可燃性气体,请写书该反应的化学方程式___________________ 。
④ ,已知该反应中B元素化合价没有变化,则
,已知该反应中B元素化合价没有变化,则 分子中6个H原子的化合价之和为
分子中6个H原子的化合价之和为______ 。
(2)以碱溶液为原料:
①
② ,则X的化学式为
,则X的化学式为______ 。
a.将铁、铝、硅三种单质均匀混合,并分成两等份。第一份加入足量盐酸充分反应,第二份加入足量的氢氧化钠溶液充分反应,二者生成等量的氢气,则混合物中,铁与硅的质量比为______ 。
b.把铝粉和 粉末均匀混合,并分成两等份。第一份在高温下发生置换反应且恰好完全反应,然后用足量盐酸与生成物充分反应;第二份直接加入足量的氢氧化钠溶液充分反应,则前后两种情况下生成的氢气分子的个数比为
粉末均匀混合,并分成两等份。第一份在高温下发生置换反应且恰好完全反应,然后用足量盐酸与生成物充分反应;第二份直接加入足量的氢氧化钠溶液充分反应,则前后两种情况下生成的氢气分子的个数比为______ 。
(3)以盐溶液为原料:
①酸性盐溶液:
②碱性盐溶液:某兴趣小组在查阅资料时发现镁条与某些碳酸氢盐溶液也能生成氢气。进而进行了探究:
经探究得到结论如下:
结论一:反应产生的气体有 和
和 。
。
结论二:反应过程中,溶液的碱性越来越强。
请回答下列问题:
a.该实验中产生 的原因为
的原因为_______________________ (用化学方程式表示)。
b.根据以上信息,可合理推测实验中产生 的速率会逐渐变
的速率会逐渐变______ (填“快”或“慢”)。
目前最理想的燃料电池燃料是氢气,某兴趣小组总结了一些制备氢气的方法:
以酸溶液为原料:如
(1)以水(或中性水溶液)为原料:
①水的光分解
②Mg与热水缓慢反应:
③
④
(2)以碱溶液为原料:
①
②
a.将铁、铝、硅三种单质均匀混合,并分成两等份。第一份加入足量盐酸充分反应,第二份加入足量的氢氧化钠溶液充分反应,二者生成等量的氢气,则混合物中,铁与硅的质量比为
b.把铝粉和
(3)以盐溶液为原料:
①酸性盐溶液:
②碱性盐溶液:某兴趣小组在查阅资料时发现镁条与某些碳酸氢盐溶液也能生成氢气。进而进行了探究:
实验操作 | 实验现象 |
| 向30 mL 1 | 持续快速产生大量气泡,溶液略显浑浊 |
结论一:反应产生的气体有
结论二:反应过程中,溶液的碱性越来越强。
请回答下列问题:
a.该实验中产生
b.根据以上信息,可合理推测实验中产生
22-23高一上·山东青岛·开学考试
类题推荐
硫酸性质是中学化学学习的重点。请回答下列问题:
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称:____________________ 写一种)。
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。
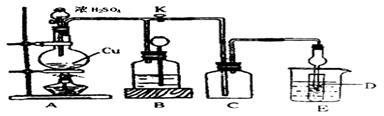
①装置B的作用是贮存多余的气体。B中应放置的液体是_______ (填序号)。
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是______ (填序号)。
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是___________________ 。
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是_____ (填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为_____________________________ 。D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)=________________ (用含硫微粒浓度的代数式表示)。
(3)利用FeCl3溶液的氧化性也可以吸收SO2。
①该反应的离子方程式是_________________________ 。检验FeCl3是否完全被还原的方法为_________________________________________________________________ 。
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05 mol·L-1 FeCl3溶液中, 溶液很快由黄色变为红褐色; 将溶液长时间放置后, 最终变为浅绿色。 关于红褐色液体, 以下是同学们的分析推测及实验。
利用胶体的_____________ (填性质) 可以检验步骤ⅰ中是否得到了Fe(OH) 3胶体。
根据反应b, 说明步骤ⅱ中液体颜色变化的原因是______________________________ (用离子方程式结合必要的文字说明) 。
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称:
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。

①装置B的作用是贮存多余的气体。B中应放置的液体是
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
(3)利用FeCl3溶液的氧化性也可以吸收SO2。
①该反应的离子方程式是
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05 mol·L-1 FeCl3溶液中, 溶液很快由黄色变为红褐色; 将溶液长时间放置后, 最终变为浅绿色。 关于红褐色液体, 以下是同学们的分析推测及实验。
| 分析推测 | 实验步骤及现象 |
| 甲: 生成了Fe(OH) 3胶体 乙: 经查阅资料, 可能发生反应: Fe3++6SO2  Fe(SO2)63+ (反应b) Fe(SO2)63+ (反应b) | ⅰ. 制备Fe(OH) 3胶体并检验 ⅱ. 分别向Fe(OH) 3胶体和该红褐色液体中加入适量铁粉, 振荡后前者不变色, 后者变为浅绿色 |
根据反应b, 说明步骤ⅱ中液体颜色变化的原因是
铝是一种应用广泛的金属。某兴趣小组对金属铝展开了系列研究。
I.研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为______ 。实验前,需要对铝的表面先进行______ (填操作)处理。兴趣小组同学将铝处理好后剪成若干大小相同的小片,用于后续实验。
(2)铝和酸、碱、盐溶液的反应
实验一的现象为_____ 。
实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为____ 。实验三表明,铝的金属活动性____ (填“大于“或”小于“)铜。
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内发现铝片表面产生的气泡较少,反应较慢。对比上述两组实验产生猜想。猜想①:稀盐酸中的氯离子对反应可能有促进作用。猜想②:____ 。为验证猜想①是否合理,应在铝和稀硫酸中加入____ (填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
Ⅱ.测定某铝样品中金属铝的质量分数
【资料1】氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
【资料2】AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl。
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。
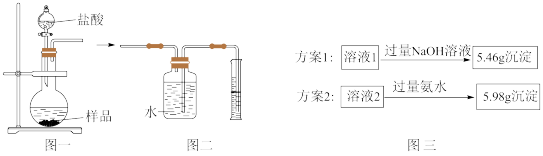
①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。_____ 。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是_____ 。
I.研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为
(2)铝和酸、碱、盐溶液的反应
| 实验 | 操作 | 现象 | 结论 |
| 一 | 将铝片放入稀盐酸中 | ,试管变烫 | 铝能与盐酸发生反应,反应放热 |
| 二 | 将铝片放入氢氧化钠溶液中 | 铝表面有气泡产生试管变烫 | 铝能与氢氧化钠溶液反应,反应放热 |
| 三 | 将铝放入硫酸铜溶液中 | 铝表面有红色物质产生,溶液逐渐变成无色 | 金属活动性:铝 铜 |
实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内发现铝片表面产生的气泡较少,反应较慢。对比上述两组实验产生猜想。猜想①:稀盐酸中的氯离子对反应可能有促进作用。猜想②:
A.Na2SO4 B.Na2CO3 C.NaCl
Ⅱ.测定某铝样品中金属铝的质量分数
【资料1】氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
【资料2】AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl。
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。

①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


