解答题-实验探究题 适中0.65 引用1 组卷144
硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是一种重要的化工产品。某化学兴趣小组利用如图装置制备硫代硫酸钠晶体(Na2S2O3·5H2O)并测定其纯度。请回答下列问题:
I.【查阅资料】
①Na2S2O3·5H2O是无色透明晶体,易溶于水。
②向Na2CO3和Na2S混合溶液中通入SO2可制Na2S2O3。
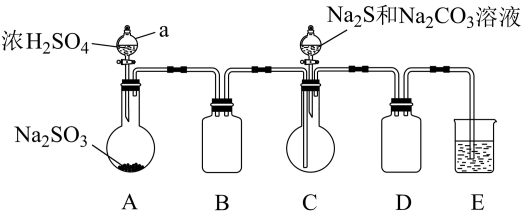
II.【制备产品】实验装置如图所示(夹持装置省略):
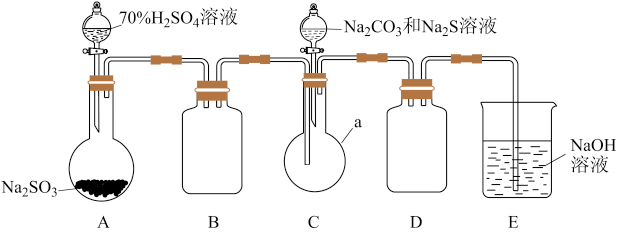
(1)制备Na2S2O3·5H2O;
①仪器a的名称为_____ 。
②装置A中发生反应的离子方程式是_____ ,实验室内制备SO2时一般采用质量分数为70%的硫酸而不用98%的浓硫酸,原因是_____ 。
(2)测定纯度:原理为2S2O +I2=S4O
+I2=S4O +2I-。准确称取mg得到的产品,用适量蒸馏水溶解并配成250mL溶液,取25mL于锥形瓶中,加入几滴淀粉溶液,用0.1000mol•L-1碘的标准溶液进行滴定。
+2I-。准确称取mg得到的产品,用适量蒸馏水溶解并配成250mL溶液,取25mL于锥形瓶中,加入几滴淀粉溶液,用0.1000mol•L-1碘的标准溶液进行滴定。
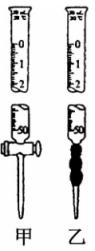
①用_____ (填“酸式”或“碱式”)滴定管盛放碘的标准溶液,滴定至终点的操作是_____ 。
②滴定起始和滴定终点的液面位置如图所示,则消耗碘的标准溶液的体积V=_____ mL,产品的纯度是______ (用含m、M的代数式表示)%。(设Na2S2O3·5H2O的摩尔质量为Mg·mol-1)
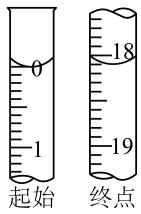
③滴定前,仰视液面读数,滴定后俯视液面读数,则所测产品的纯度_____ (填“偏高”、“偏低”或“无影响”)。
I.【查阅资料】
①Na2S2O3·5H2O是无色透明晶体,易溶于水。
②向Na2CO3和Na2S混合溶液中通入SO2可制Na2S2O3。
II.【制备产品】实验装置如图所示(夹持装置省略):

(1)制备Na2S2O3·5H2O;
①仪器a的名称为
②装置A中发生反应的离子方程式是
(2)测定纯度:原理为2S2O
①用
②滴定起始和滴定终点的液面位置如图所示,则消耗碘的标准溶液的体积V=

③滴定前,仰视液面读数,滴定后俯视液面读数,则所测产品的纯度
22-23高二下·江苏常州·阶段练习
类题推荐
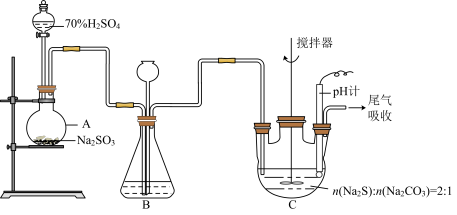
硫代硫酸钠(Na2S2O3)俗称海波、大苏打,是重要的化工原料,工业上常利用含硫废水生产Na2S2O3·5H2O,某化学兴趣小组在实验室中用如图所示装置(加热装置及部分夹持装置已略去)模拟其生产过程并探究其化学性质。

烧瓶C中发生如下反应:
①Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
②2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
③S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
I.制备Na2S2O3·5H2O
(1)加入药品之前须进行的操作是_____ ;装置D的作用是_______ ;装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用_______ (填字母)。
A.蒸馏水 B.饱和Na2SO3溶液 C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(2)为保证硫代硫酸钠的产量,实验中产生的SO2不能过量,原因是_______ ;该实验不使用过浓或过稀的硫酸,而使用70%的硫酸的原因是_______ 。
II.测定产品纯度
准确称取wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.10mol∙L-1I2的标准溶液滴定。反应原理为2 +I2=
+I2= +2I-
+2I-
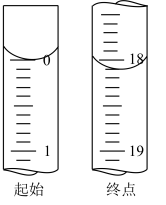
(3)滴定至终点时的现象:_______ 。滴定起始和终点时I2的标准溶液液面位置如图所示,则消耗I2的标准溶液的体积为_______ mL。产品的纯度为_______ %(设Na2S2O3·5H2O的相对分子质量为M,列出用M、w表示的表达式)。

III.探究Na2S2O3的部分化学性质
(4)
实验结论:_______ 。
IV.Na2S2O3的应用
(5) 可与一些金属离子形成稳定的络离子,常用于除重金属离子和照相行业的定影剂。已知AgBr可溶于Na2S2O3溶液,生成配位数为2的络合物,请写出该化学方程式:
可与一些金属离子形成稳定的络离子,常用于除重金属离子和照相行业的定影剂。已知AgBr可溶于Na2S2O3溶液,生成配位数为2的络合物,请写出该化学方程式:_______ 。

烧瓶C中发生如下反应:
①Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
②2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
③S(s)+Na2SO3(aq)
I.制备Na2S2O3·5H2O
(1)加入药品之前须进行的操作是
A.蒸馏水 B.饱和Na2SO3溶液 C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(2)为保证硫代硫酸钠的产量,实验中产生的SO2不能过量,原因是
II.测定产品纯度
准确称取wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.10mol∙L-1I2的标准溶液滴定。反应原理为2
(3)滴定至终点时的现象:

III.探究Na2S2O3的部分化学性质
(4)
| 实验操作 | 实验结论或现象 | 现象解释(用离子方程式表示) |
| 用pH试纸测Na2S2O3溶液酸碱性 | 溶液pH=8 | |
| 向溴水中滴入适量Na2S2O3溶液 | 溴水褪色 |
IV.Na2S2O3的应用
(5)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网