解答题-实验探究题 较难0.4 引用2 组卷171
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某化学兴趣小组设计实验制备NaNO2并探究其性质。
查阅资料信息:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②酸性KMnO4溶液可将低价氮的氧化物或酸根离子氧化为NO 。
。
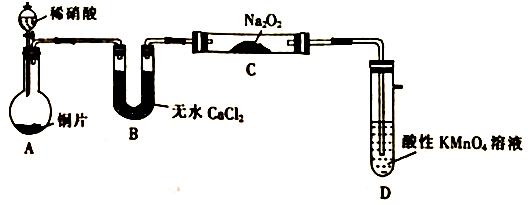
(1)NaNO2的制备(夹持装置和加热装置均已略,已检查装置气密性)。
①若没有装置B,则装置C中Na2O2与水发生反应:_____ (写化学方程式)。
②制得的NaNO2固体中混有的杂质主要为NaNO3,改进措施是在装置A、B间添加_____ ,提高NaNO2的纯度。
③装置E中发生的主要反应的离子方程式为_____ 。
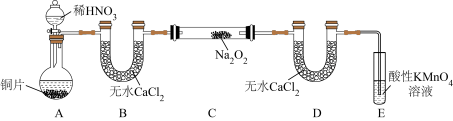
(2)验证亚硝酸钠与70%硫酸反应的气体产物为NO和NO2的混合气体。
已知:FeSO4溶液可吸收NO;NO2的沸点为21℃,熔点为-11℃。

①为了检验装置A中生成的气体产物,装置的连接顺序是A→_____ 。(按气流方向从左到右)
②反应前应打开弹簧夹1,先通入一段时间氮气,目的是_____ 。
(3)测定某亚硝酸钠样品的纯度。
设该样品的杂质均不与酸性KMnO4溶液反应,可用酸性KMnO4溶液测定NaNO2的含量。称取2.0g亚硝酸钠样品溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再用0.1000mol•L-1的酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液的体积如表:
该亚硝酸钠样品中NaNO2的质量分数为______ 。
查阅资料信息:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②酸性KMnO4溶液可将低价氮的氧化物或酸根离子氧化为NO
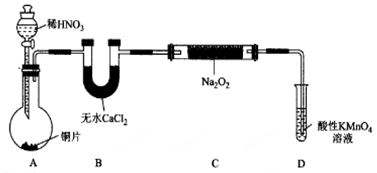
(1)NaNO2的制备(夹持装置和加热装置均已略,已检查装置气密性)。

①若没有装置B,则装置C中Na2O2与水发生反应:
②制得的NaNO2固体中混有的杂质主要为NaNO3,改进措施是在装置A、B间添加
③装置E中发生的主要反应的离子方程式为
(2)验证亚硝酸钠与70%硫酸反应的气体产物为NO和NO2的混合气体。
已知:FeSO4溶液可吸收NO;NO2的沸点为21℃,熔点为-11℃。

①为了检验装置A中生成的气体产物,装置的连接顺序是A→
②反应前应打开弹簧夹1,先通入一段时间氮气,目的是
(3)测定某亚硝酸钠样品的纯度。
设该样品的杂质均不与酸性KMnO4溶液反应,可用酸性KMnO4溶液测定NaNO2的含量。称取2.0g亚硝酸钠样品溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再用0.1000mol•L-1的酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液的体积如表:
| 实验组 | 第一组 | 第二组 | 第三组 | 第四组 |
| 消耗酸性KMnO4标准溶液的体积/mL | 9.97 | 10.02 | 12.01 | 10.01 |
22-23高二下·云南大理·阶段练习
类题推荐
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验Ⅰ】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):
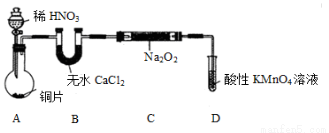
(1)装置A中用于盛放稀HNO3溶液的仪器名称为________ ;写出装置A中发生主要反应的离子方程式:__________ 。
(2)装置D的作用是____________ ;
(3)如果没有B装置,C中发生的副反应的化学方程式①_______ 、②______ 。
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列哪种方案可以提高NaNO2纯度________ 。
A.将B中的药品换为碱石灰 B.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 D.在A、B之间增加盛有水的洗气瓶
【实验Ⅱ】测定NaNO2样品中NaNO3的含量
步骤:(1)配置KMnO4标准溶液并酸化,酸化KMnO4的酸应选择________ (填化学式)
(2)已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4 20.00mL,酸性KMnO4的作用是______ 和_______ ,计算所得固体中亚硝酸钠的质量分数__________ 。(结果保留一位小数)
【扩展实验Ⅲ】该学习小组为再了解氧族元素的一些典型化合物的性质,进行了如下实验探究。
经查知:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分 可能是SO2、SO3和O2中的一种、两种或三种。他们通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如图所示:
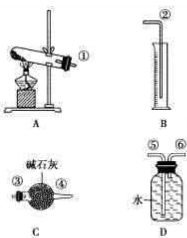
(1)提出猜想
①所得气体的成分可能只含________ 一种;
②所得气体的成分可能含有________ 两种;
③所得气体的成分可能含有SO2、SO3和O2三种。
(2)实验探究
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,则仪器接口的连接顺序为______ (填序号)。
②由于加热时的温度不同,实验结束后测得相关数据也不同。数据如下:
请通过计算,推断出第一组和第二组的实验条件下CuSO4分解反应的化学方程式:
第一组_________________ ; 第二组_________________ 。
【实验Ⅰ】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):

(1)装置A中用于盛放稀HNO3溶液的仪器名称为
(2)装置D的作用是
(3)如果没有B装置,C中发生的副反应的化学方程式①
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列哪种方案可以提高NaNO2纯度
A.将B中的药品换为碱石灰 B.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 D.在A、B之间增加盛有水的洗气瓶
【实验Ⅱ】测定NaNO2样品中NaNO3的含量
步骤:(1)配置KMnO4标准溶液并酸化,酸化KMnO4的酸应选择
(2)已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4 20.00mL,酸性KMnO4的作用是
【扩展实验Ⅲ】该学习小组为再了解氧族元素的一些典型化合物的性质,进行了如下实验探究。
经查知:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分 可能是SO2、SO3和O2中的一种、两种或三种。他们通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如图所示:

(1)提出猜想
①所得气体的成分可能只含
②所得气体的成分可能含有
③所得气体的成分可能含有SO2、SO3和O2三种。
(2)实验探究
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,则仪器接口的连接顺序为
②由于加热时的温度不同,实验结束后测得相关数据也不同。数据如下:
| 实验 | 称取CuSO4的质量/g | 仪器C 增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 第一组 | 6.4 | 2.88 | 224 |
| 第二组 | 6.4 | 2.56 | 448 |
第一组
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网