解答题-结构与性质 较难0.4 引用1 组卷249
碳酸二甲酯(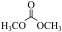 )是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
)是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
i.
ii.
(1)碳酸二甲酯分子中碳原子的杂化类型是___________ 。
(2)CuCl中,基态 的价电子排布式为
的价电子排布式为___________ ,CuCl在生产碳酸二甲酯的反应过程中所起的作用是___________ 。
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受 (+1价铜元素)浓度的影响。
(+1价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度较小,且其中的 易被氧化为难溶的CuO。
易被氧化为难溶的CuO。
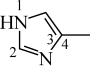
iii.加入4-甲基咪唑(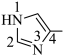 )可与
)可与 形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
请结合信息回答以下问题。
①4-甲基咪唑中,1~4号原子___________ (填“在”或“不在”)同一平面上,___________ (填“1”或“3”)号N原子更容易与 形成配位键。
形成配位键。
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是___________ (填序号)。
a. 配合物中的-NH结构可增大其在甲醇中的溶解度
配合物中的-NH结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免 被氧化为难溶的CuO
被氧化为难溶的CuO
c.形成的 配合物能增大反应的限度
配合物能增大反应的限度
(4)配位原子提供孤电子对的能力是影响配体与 之间配位键强度的一个重要因素。若用某结构相似的含O配体与
之间配位键强度的一个重要因素。若用某结构相似的含O配体与 配位,所得配合物的稳定性比含N配体低,可能的原因是
配位,所得配合物的稳定性比含N配体低,可能的原因是___________ 。
 )是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
)是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。i.
ii.
(1)碳酸二甲酯分子中碳原子的杂化类型是
(2)CuCl中,基态
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受
ii.CuCl在甲醇中溶解度较小,且其中的
iii.加入4-甲基咪唑(
 )可与
)可与请结合信息回答以下问题。
①4-甲基咪唑中,1~4号原子
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是
a.
b.通过形成配合物,避免
c.形成的
(4)配位原子提供孤电子对的能力是影响配体与
22-23高二下·北京东城·阶段练习
类题推荐
Ⅰ.锂离子电池广泛应用于电源领域,锂离子电池目前广泛采用溶有六氟磷酸锂( )的碳酸酯作电解液。
)的碳酸酯作电解液。
(1) 中各元素第一电离能从大到小的关系是
中各元素第一电离能从大到小的关系是_______ (用元素符号表示)。
(2) 中存在的化学键_______(填序号)。
中存在的化学键_______(填序号)。
Ⅱ.碳酸二甲酯是一种低毒、环保性能优异、用途广泛的化工原料。还可以用于汽车、医疗器械等领域。由 、甲醇为原料合成绿色化学品碳酸二甲酯(
、甲醇为原料合成绿色化学品碳酸二甲酯( )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:

(3)碳酸二甲酯分子中O—C—O键的键角_______  (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而第一电离能较低;
②_______ 。
(5)下列说法不正确的是_______ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B. 极易溶解在水中,主要是因为氨分子与水分子间的范德华力作用强
极易溶解在水中,主要是因为氨分子与水分子间的范德华力作用强
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅲ.废旧锂离子电池含 的正极材料经预处理后,可采用如图原理富集Ni元素。
的正极材料经预处理后,可采用如图原理富集Ni元素。

(6)基态Ni+价电子的轨道表示式是_______ 。
(7)DMG中N原子均与 配位,且
配位,且 的配位数是4;DMG-Ni中两个配体之间形成分子内氢键。写出DMG—Ni的结构简式
的配位数是4;DMG-Ni中两个配体之间形成分子内氢键。写出DMG—Ni的结构简式______ (用“→”标出配位键,用“…”标出氢键)。
Ⅳ.石墨可作锂离子电池的负极材料。充电时,嵌入石墨层间。当嵌入最大量时,晶体部分结构的俯视示意图如图。

(8)此时C与 的个数比是
的个数比是_______ 。
(1)
(2)
| A.共价键 | B.离子键 | C.金属键 | D.配位键 |
Ⅱ.碳酸二甲酯是一种低毒、环保性能优异、用途广泛的化工原料。还可以用于汽车、医疗器械等领域。由
 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(3)碳酸二甲酯分子中O—C—O键的键角
(4)尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而第一电离能较低;
②
(5)下列说法不正确的是
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅲ.废旧锂离子电池含

(6)基态Ni+价电子的轨道表示式是
(7)DMG中N原子均与
Ⅳ.石墨可作锂离子电池的负极材料。充电时,嵌入石墨层间。当嵌入最大量时,晶体部分结构的俯视示意图如图。

(8)此时C与
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
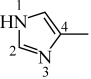

 )形成配合物。
)形成配合物。