解答题-工业流程题 较难0.4 引用1 组卷132
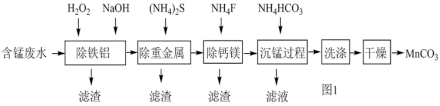
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用含锰的酸性废水(主要金属离子为 、
、 、
、 ,还含有少量
,还含有少量 、
、 、
、 和
和 等离子)为原料,生产
等离子)为原料,生产 的工艺流程如图1。
的工艺流程如图1。
已知该条件下 、
、 。
。
(1)流程中含锰废水经过前三步预处理,得到主要含有 的母液。
的母液。
①除铁铝时,在搅拌条件下先加入 溶液,再加入
溶液,再加入 溶液调节
溶液调节 ,加入
,加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_______ 。
②除重金属时,滤渣的主要成分为_______ 。(填化学式)
③除钙镁时,为使 沉淀完全(当离子浓度降到
沉淀完全(当离子浓度降到 时,可视为沉淀完全),需控制溶液中
时,可视为沉淀完全),需控制溶液中 的最低浓度为
的最低浓度为_______  。
。
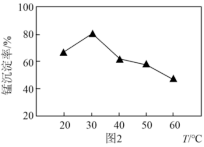
(2)沉锰过程在 为7.0条件下充分进行,反应温度对锰沉淀率的影响如图2所示。
为7.0条件下充分进行,反应温度对锰沉淀率的影响如图2所示。
①沉锰过程发生反应的离子方程式为_______ 。
②当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是_______ 。
(3)沉锰后过滤得到 粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的
粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的 ,用无水乙醇洗涤的目的是
,用无水乙醇洗涤的目的是_______ 。
(4)测定碳酸锰产品的纯度:称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为 ,冷却至室温,加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为
,冷却至室温,加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为 的硫酸亚铁铵 [
的硫酸亚铁铵 [ ]标准溶液滴定(反应为
]标准溶液滴定(反应为 ),重复操作3次,记录数据如表,则产品的纯度=
),重复操作3次,记录数据如表,则产品的纯度=_______ (MMn=55)。

已知该条件下
(1)流程中含锰废水经过前三步预处理,得到主要含有
①除铁铝时,在搅拌条件下先加入
②除重金属时,滤渣的主要成分为
③除钙镁时,为使
(2)沉锰过程在

①沉锰过程发生反应的离子方程式为
②当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是
(3)沉锰后过滤得到
(4)测定碳酸锰产品的纯度:称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为
| 滴定次数 | 0.2000mol/L的硫酸亚铁铵标准溶液读数 (mL) | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
22-23高二下·四川眉山·阶段练习
类题推荐
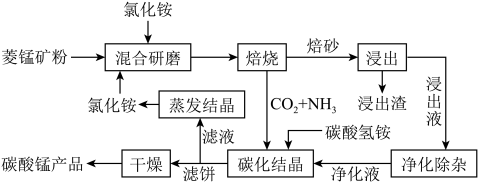
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:
③常温下,Ksp(CaF2) ═1.46×10-10 Ksp(MgF2) ═7.42×10-11 Ka(HF) ═1.00 ×10-4
回答下列问题:
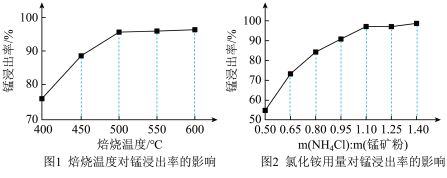
(1)分析下列图1、图2,氯化铵焙烧锰矿粉的最佳条件是:__________________ 。
(2)“焙烧”时发生的主要反应的化学方程式为_________________________ 。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为__________ ;再调节溶液的pH将Al3+、Fe3+变为沉淀除去;然后加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液pH为6,c(Mg2+)═4.64×10-6 mol·L-1,c(HF)为_________ mol·L-1。
(4)碳化结晶时,反应的离子方程式为_____________________________________ 。
(5)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________ 。
(6)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
则产品的纯度=__________ ,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度___ (填“偏高”“ 偏低”或“无影响”)。

已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 完全沉淀的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)分析下列图1、图2,氯化铵焙烧锰矿粉的最佳条件是:

(2)“焙烧”时发生的主要反应的化学方程式为
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为
(4)碳化结晶时,反应的离子方程式为
(5)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是
(6)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
| 滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:

回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_____________________________ 。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为__________ ③加入NH4F将___________ 离子(填离子符号)沉淀除去。
(3)碳化结晶时,反应的离子方程式为_____________________________________ 。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是________________ 。流程中能循环利用的物质除了氯化铵之外还有____________ 。
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
则产品的纯度=__________ ,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_______ (填“偏高”“ 偏低”或“无影响”)。
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
| 沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |

回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为
(3)碳化结晶时,反应的离子方程式为
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
| 滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
则产品的纯度=
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
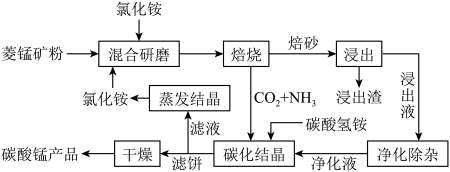
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1mol•L -1形成M(OH)n沉淀的pH范围如下:
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___ 。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__ 将Al3+、Fe3+变为沉淀除去;③加入NH4F将__ 离子沉淀除去。写出反应①的离子方程式为___ ;
(3)碳化结晶时,反应的离子方程式为___ 。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__ 。流程中能循环利用的物质除了氯化铵之外还有__ 。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
则产品的纯度=__ ,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__ (填“偏高”“偏低”或“无影响”)。

已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1mol•L -1形成M(OH)n沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
| 沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
(1)“焙烧”时发生的主要反应的化学方程式为
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②
(3)碳化结晶时,反应的离子方程式为
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
| 滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


