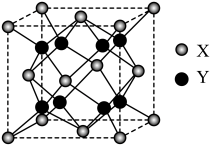
填空题 适中0.65 引用1 组卷114
H、C、N、O、F、S等是重要的非金属元素,回答下列问题:
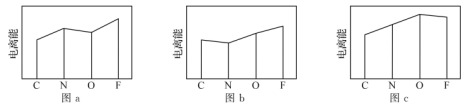
(1)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第二电离能的变化图是_______ (填标号),判断的根据是_______ 。
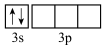
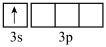
(2)已知C—H、C—F的键能分别为413.4 、485
、485 。在2022年冬奥会上“水立方”华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(
。在2022年冬奥会上“水立方”华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯( )与四氟乙烯(
)与四氟乙烯( )的共聚物(ETFE)制成。
)的共聚物(ETFE)制成。 、
、 分子的稳定性关系:前者
分子的稳定性关系:前者_______ 后者(填“大于”或“小于”),原因是_______ 。
(3)相同条件下, 与
与 在水中的溶解度较大的是
在水中的溶解度较大的是_______ (写分子式),理由是_______ 。
(4)已知 比
比 接收质子的能力强,可能的原因是
接收质子的能力强,可能的原因是_______ 。
(1)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第二电离能的变化图是

(2)已知C—H、C—F的键能分别为413.4
(3)相同条件下,
(4)已知
22-23高二下·山西忻州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


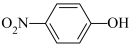 )等。对硝基苯酚的熔点高于邻硝基苯酚(
)等。对硝基苯酚的熔点高于邻硝基苯酚( )的熔点,其原因是
)的熔点,其原因是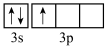
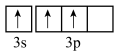 C.
C.