解答题-实验探究题 适中0.65 引用3 组卷548
某小组研究钠与不同浓度盐酸的反应。
【实验操作】
取5块质量均为0.20 g且形状相似的金属钠,分别放入20 mL不同浓度的盐酸中,如图。
【实验现象与数据】
经检验,⑤中出现的白色浑浊中的固体为NaCl。
【问题与讨论】
(1)补全钠与盐酸反应的化学方程式:
_______ :
(2)小组得出结论:钠的密度小于盐酸的密度,依据的实验现象是_______ 。
(3)在上述实验中,盐酸浓度越大,钠完全消失所用的时间_______ 。
(4)在上述实验中,钠完全消失所用的时间不同。原因可能是:盐酸浓度越大,化学反应越快,但是生成的氯化钠改变了盐酸与钠的_______ ,该因素影响了化学反应速率,进而影响了钠完全消失所用的时间。
【实验操作】
取5块质量均为0.20 g且形状相似的金属钠,分别放入20 mL不同浓度的盐酸中,如图。

【实验现象与数据】
| 编号 | ① | ② | ③ | ④ | ⑤ |
| c(HCl)/(mol·L-1) | 0.5 | 1.0 | 1.5 | 3.0 | 6.0 |
| 主要现象 | 钠浮在液面上,四处游动 | ||||
| 钠燃烧。溶液澄清 | 钠短时燃烧。溶液澄清 | 钠的表面有火花。溶液澄清 | 钠的表面。有少量火花。溶液澄清 | 钠的周围出现白色浑浊,一段时间后变澄清 | |
| 钠完全消失所用的时间/s | 11 | 21 | 37 | 65 | 114 |
【问题与讨论】
(1)补全钠与盐酸反应的化学方程式:
(2)小组得出结论:钠的密度小于盐酸的密度,依据的实验现象是
(3)在上述实验中,盐酸浓度越大,钠完全消失所用的时间
(4)在上述实验中,钠完全消失所用的时间不同。原因可能是:盐酸浓度越大,化学反应越快,但是生成的氯化钠改变了盐酸与钠的
2023高二·北京·学业考试
类题推荐
某同学在实验室研究锌与酸的反应,实验数据如下:
分析上述数据,回答下列问题
(1)实验1和2表明,_____ 对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =________ g。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。
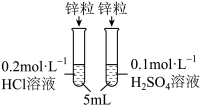
该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b.________ ,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___ (结合化学方程式作出合理解释)。
| 实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
| 1 | 0.10 g | 颗粒 | 0.5mol·L-1 | 50mL | 500s |
| 2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
| 3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
分析上述数据,回答下列问题
(1)实验1和2表明,
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。

该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b.
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是
(一)某同学在实验室研究锌与酸的反应,实验数据如下:
分析上述数据,回答下列问题
(1)实验1和2表明,___________ 对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a=___________ g,实验3金属消失所用的时间比实验1要短,请用有效碰撞理论加以解释___________ 。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。该同学对产生这一现象的原因,提出两种假设:

a.氯离子对反应起促进作用,加快了反应的进行;
b.___________ ,减缓了反应的进行。
为进一步证实猜想b,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液于两支试管中,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___________ (结合化学方程式 作出合理解释)。
(二)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:
(5)该反应为___________ 反应(填“吸热”或“放热”)。
(6)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率___________ (填“大”、“小”或“不能确定”)。
| 实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
| 1 | 0.10 g | 颗粒 | 0.5mol/L | 50mL | 500s |
| 2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
| 3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
(1)实验1和2表明,
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a=
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。该同学对产生这一现象的原因,提出两种假设:

a.氯离子对反应起促进作用,加快了反应的进行;
b.
为进一步证实猜想b,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液于两支试管中,一份加入一定量的固体
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是
(二)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(5)该反应为
(6)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率
科学探究与创新意识是化学学科核心素养之一。回答下列问题:
Ⅰ.某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果。
(1)实验①的导线中电子流向为_________ (填“A→B”或“B→A”)。
(2)实验④的导线中电流由A极流向B极,表明负极是___________ 电极(填元素名称),正极反应式为________ 。
(3)分析上表有关信息,下列说法错误的是_________ (填标号)。
a.烧杯中的液体必须是电解质溶液
b.相对活泼的金属一定做负极
c.钢铁在潮湿的空气中不会被腐蚀
d.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
Ⅱ.某化学兴趣小组研究钠与不同浓度盐酸的反应。
【实验操作】
取5块质量均为0.20g且形状相似的金属钠,分别放入20mL不同浓度的盐酸中,如图所示。
【实验现象与数据】
经检验,⑤中出现的白色浑浊中的固体为NaCl。
【问题与讨论】
(4)写出钠与盐酸反应的离子方程式________ 。
(5)实验①中能说明钠与盐酸反应放热的实验现象是________ 。
(6)在上述实验中,盐酸浓度越大,钠完全消失所用的时间________ (填越“长”或“越短”)。
(7)实验⑤中钠完全消失所用的时间最长,反应速率最慢,原因可能是________ 。
Ⅰ.某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果。
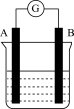 | 实验序号 | A | B | 烧杯中的液体 | 灵敏电流计指针是否偏转 |
① | Fe | Cu | 稀硫酸 | 有 | |
② | Fe | Fe | 稀硫酸 | 无 | |
③ | Fe | Cu | 苯 | 无 | |
④ | Fe | Cu | 浓硝酸 | 有 | |
⑤ | C | Fe | 氯化钠溶液 | 有 |
(2)实验④的导线中电流由A极流向B极,表明负极是
(3)分析上表有关信息,下列说法错误的是
a.烧杯中的液体必须是电解质溶液
b.相对活泼的金属一定做负极
c.钢铁在潮湿的空气中不会被腐蚀
d.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
Ⅱ.某化学兴趣小组研究钠与不同浓度盐酸的反应。
【实验操作】
取5块质量均为0.20g且形状相似的金属钠,分别放入20mL不同浓度的盐酸中,如图所示。

【实验现象与数据】
编号 | ① | ② | ③ | ④ | ⑤ |
0.5 | 1.0 | 1.5 | 3.0 | 6.0 | |
主要现象 | 钠浮在液面上,四处游动 | ||||
钠燃烧。 溶液澄清 | 钠短时燃烧。 溶液澄清 | 钠的表面有火花。溶液澄清 | 钠的表面有少量火花。 溶液澄清 | 钠的周围出现白色浑浊,一段时间后变澄清 | |
钠完全消失 所用的时间/s | 11 | 21 | 37 | 65 | 114 |
【问题与讨论】
(4)写出钠与盐酸反应的离子方程式
(5)实验①中能说明钠与盐酸反应放热的实验现象是
(6)在上述实验中,盐酸浓度越大,钠完全消失所用的时间
(7)实验⑤中钠完全消失所用的时间最长,反应速率最慢,原因可能是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


