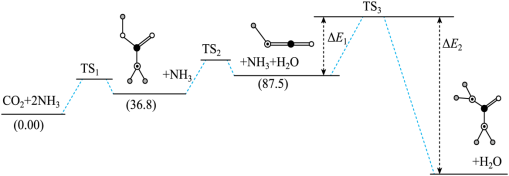
解答题-原理综合题 适中0.65 引用2 组卷170
2021年全国两会上“碳达峰”和“碳中和”被首次写入政府工作报告, 的回收和利用越来越受到国际社会的重视。
的回收和利用越来越受到国际社会的重视。
I.利用 合成甲醇。
合成甲醇。
(1)
___________ 。
(2) 加氢制甲醇,甲醇与CO是主要产物,发生的平行反应:
加氢制甲醇,甲醇与CO是主要产物,发生的平行反应:
Ⅰ.
Ⅱ.
①对于反应 ,
, ,其中
,其中 分别为正逆反应速率常数,
分别为正逆反应速率常数, 为气体分压。则升高温度,
为气体分压。则升高温度,
___________ (填“变大”“变小”或“不变”);
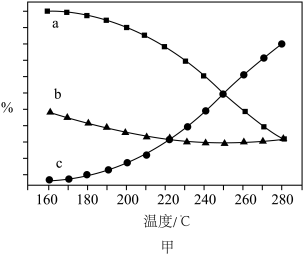
②温度对该反应平衡体系中CO、 的百分含量影响如图甲所示,曲线a、b、c对应物质的化学式分别为
的百分含量影响如图甲所示,曲线a、b、c对应物质的化学式分别为___________ 、___________ 、___________ ;
③某温度下,向压强为p的恒容密闭容器中按 进行投料,若平衡时
进行投料,若平衡时 的产率为0.6,
的产率为0.6, 的物质的量为1.0mol,则平衡时容器内压强为
的物质的量为1.0mol,则平衡时容器内压强为___________ 。
Ⅱ.利用 合成二甲醚
合成二甲醚
(3)合成二甲醚反应: ,将2mol
,将2mol 通入容积为2L的恒容密闭容器中合成二甲醚,200℃时容器内
通入容积为2L的恒容密闭容器中合成二甲醚,200℃时容器内 的物质的量随时间的变化如图乙所示:
的物质的量随时间的变化如图乙所示:
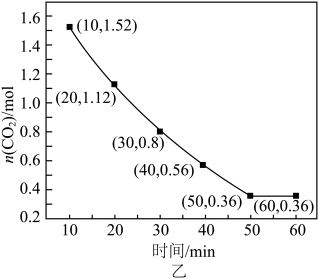
①30~40min内,消耗 的平均反应速率为
的平均反应速率为___________  ;
;
②能说明反应已达平衡状态的是___________ (填标号)。
a.
b.断裂2个H-H键,同时断裂2个H-O键
c.密闭容器内压强不变
d.混合气体的密度不变
(4)向一恒容密闭容器中充入3mol 和6mol
和6mol  ,开始测得气体的总压为4.5MPa,在一定温度下合成二甲醚,10min后达到平衡,测得
,开始测得气体的总压为4.5MPa,在一定温度下合成二甲醚,10min后达到平衡,测得 的转化率为50%,该反应的平衡常数
的转化率为50%,该反应的平衡常数
___________  (保留2位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(保留2位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
I.利用
| 物质 | |||
| 燃烧热 |
(2)
Ⅰ.
Ⅱ.
①对于反应
②温度对该反应平衡体系中CO、

③某温度下,向压强为p的恒容密闭容器中按
Ⅱ.利用
(3)合成二甲醚反应:

①30~40min内,消耗
②能说明反应已达平衡状态的是
a.
b.断裂2个H-H键,同时断裂2个H-O键
c.密闭容器内压强不变
d.混合气体的密度不变
(4)向一恒容密闭容器中充入3mol
22-23高三下·河南洛阳·阶段练习
类题推荐
研发CO2利用技术、降低空气中CO2含量可采用“CO2催化加氢制甲醇”方法。
该反应体系中涉及以下两个反应:
Ⅰ.
Ⅱ.
回答下列问题:
(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
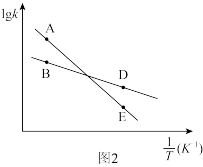
(2)反应Ⅰ、Ⅱ的InK(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
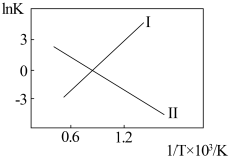
试判断升高温度,反应 的化学平衡常数
的化学平衡常数___________ (填“增大”或“减小”或“不变”)。
(3)恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
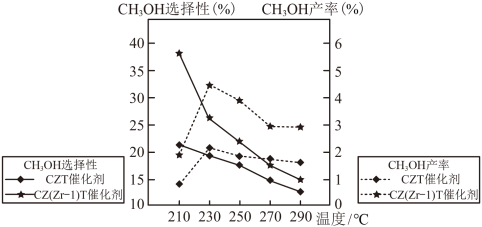
其中:CH3OH的选择性
①在上述条件下合成甲醇的工业条件是___________ 。
A.210℃ B.230℃ C.催化ZT D.催化剂CZ(Zr-1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是___________ 。
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应Ⅰ和反应Ⅱ,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则反应Ⅱ的平衡常数K=___________ (保留两位有效数字)。
(5)已知对于反应Ⅰ, ,
, 。其中
。其中 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
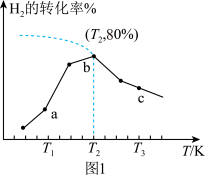
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比 分别为3∶1、1∶1、1∶3,得到不同压强条件下H2的平衡转化率关系如图所示。
分别为3∶1、1∶1、1∶3,得到不同压强条件下H2的平衡转化率关系如图所示。
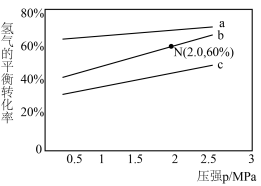
①比较a、b、c各曲线所表示的投料比大小顺序为___________ (用字母表示)。
②计算540K的压强平衡常数
___________ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻 ,
, ,
, ,此时
,此时
___________ 。
该反应体系中涉及以下两个反应:
Ⅰ.
Ⅱ.
回答下列问题:
(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO的浓度,反应Ⅰ的平衡向正反应方向移动 |
| B.降低温度,反应Ⅰ和Ⅱ的正、逆反应速率都减小 |
| C.恒温恒容下充入氦气,反应Ⅰ的平衡向正反应方向移动 |
| D.增大压强,反应Ⅰ和Ⅱ重新达到平衡的时间不同 |

试判断升高温度,反应
(3)恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性
①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化ZT D.催化剂CZ(Zr-1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应Ⅰ和反应Ⅱ,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则反应Ⅱ的平衡常数K=
(5)已知对于反应Ⅰ,

①比较a、b、c各曲线所表示的投料比大小顺序为
②计算540K的压强平衡常数
③540K条件下,某容器测得某时刻
“十三五”期间中国应对气候变化工作取得显著成效,并向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。CO2的的回收及综合利用越来越受到国际社会的重视,将CO2转化为高附加值化学品已成为有吸引力的解决方案。
I.CO2合成二甲醚(DME):
(1)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)。
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49kJ/mol
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-25kJ/mol
则合成二甲醚的反应的ΔH=_______ kJ/mol。
(2)将1 mol CO2、3mol H2通入容积为1L的恒容密闭容器中合成二甲醚,200℃时容器内CO2的物质的量随时间的变化如表所示:
①0~40min内,消耗H2的平均反应速率为_______ mol·L-1·min-1
②能说明反应已达平衡状态的是_______ (填标号)
a.c(CO2):c(H2O)=1:6 b.混合气体的密度不变 c.2v正(H2)=v逆(H2O) d.密闭容器内压强不变
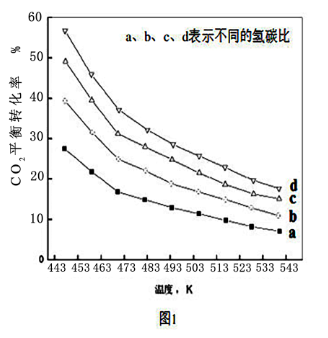
(3)在不同温度和不同氢碳比时,合成二甲醚反应CO2的平衡转化率如图1所示,则图中氢碳比由大到小的关系是_______ (用a、b、c、d表示)。
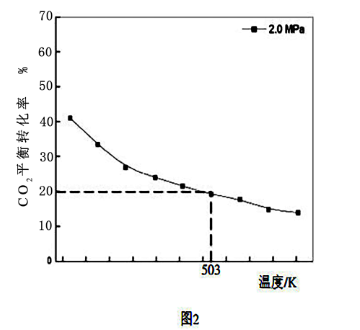
(4)在503K时,当以氢碳比为0.9时合成二甲醚(如图2),则化学平衡常数Kp=_______ MPa-4(用气体的平衡分压代替物质的量浓度计算压强平衡常数Kp,气体分压=气体总压×各气体的体积分数,列出表达式)。
II.CO2合成甲醇(MT):
(5)合成甲醇反应:I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49kJ/mol
逆水煤气反应:II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=+41.17kJ/mol
CO合成甲醇反应:Ⅲ.CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.18kJ/mol
在不同条件下CO2平衡转化率和甲醇的平衡产率如图所示:
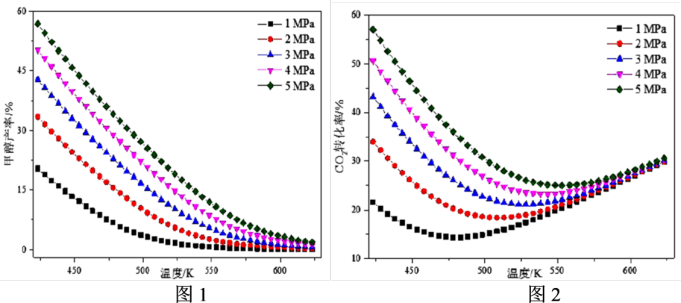
①图1中甲醇的平衡产率随温度升高而降低的原因是_______ 。
②由图2可知,不同压强下CO2的平衡转化率在550℃后趋于相等,原因是_______ 。
I.CO2合成二甲醚(DME):
(1)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)。
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49kJ/mol
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-25kJ/mol
则合成二甲醚的反应的ΔH=
(2)将1 mol CO2、3mol H2通入容积为1L的恒容密闭容器中合成二甲醚,200℃时容器内CO2的物质的量随时间的变化如表所示:
| 时间/min-1 | 10 | 20 | 30 | 40 | 50 | 60 |
| n(CO2)mol | 0.31 | 0.53 | 0.40 | 0.30 | 0.20 | 0.20 |
①0~40min内,消耗H2的平均反应速率为
②能说明反应已达平衡状态的是
a.c(CO2):c(H2O)=1:6 b.混合气体的密度不变 c.2v正(H2)=v逆(H2O) d.密闭容器内压强不变
(3)在不同温度和不同氢碳比时,合成二甲醚反应CO2的平衡转化率如图1所示,则图中氢碳比由大到小的关系是

(4)在503K时,当以氢碳比为0.9时合成二甲醚(如图2),则化学平衡常数Kp=

II.CO2合成甲醇(MT):
(5)合成甲醇反应:I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49kJ/mol
逆水煤气反应:II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=+41.17kJ/mol
CO合成甲醇反应:Ⅲ.CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.18kJ/mol
在不同条件下CO2平衡转化率和甲醇的平衡产率如图所示:

①图1中甲醇的平衡产率随温度升高而降低的原因是
②由图2可知,不同压强下CO2的平衡转化率在550℃后趋于相等,原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网