解答题-原理综合题 较难0.4 引用1 组卷206
亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与 合成,请分析并回答:
合成,请分析并回答:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,热化学方程式和平衡常数如下:
则
___________ (用 、
、 表示)。
表示)。
(2)25°C时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04mol ,发生反应:
,发生反应: ,
, 。
。
①下列描述能说明该反应已达到平衡状态的是___________ (填序号)。
A.
B.容器内混合气体的密度保持不变
C.容器内气体压强保持不变
D.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则
___________ 0(填“>”、“<”或“不确定”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图Ⅰ曲线b所示,则改变的条件是___________ 。
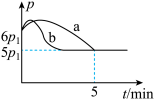
③试求算m值为___________ 。在图Ⅱ中描绘上述反应平衡常数的对数值( )与温度的变化关系趋势图线(m为起点)
)与温度的变化关系趋势图线(m为起点)_____ 。

④此时,NO的转化率为___________ 。
(3)利用亚硝酰氯与适量NaOH溶液反应后的其中含氮产物X,再与NaOH等溶液一起,可以使铁表面氧化形成致密氧化膜(先分别生成 、
、 ,再生成铁的氧化物),试写出最后生成氧化膜的离子反应方程式:
,再生成铁的氧化物),试写出最后生成氧化膜的离子反应方程式:___________ 。
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,热化学方程式和平衡常数如下:
| 序号 | 热化学方程式 | 平衡常数 |
| ① | ||
| ② | ||
| ③ |
则
(2)25°C时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04mol
①下列描述能说明该反应已达到平衡状态的是
A.
B.容器内混合气体的密度保持不变
C.容器内气体压强保持不变
D.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则

③试求算m值为

④此时,NO的转化率为
(3)利用亚硝酰氯与适量NaOH溶液反应后的其中含氮产物X,再与NaOH等溶液一起,可以使铁表面氧化形成致密氧化膜(先分别生成
2022·浙江·模拟预测
类题推荐
亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
则ΔH3=_________ (用ΔH1、ΔH2表示);K3=__________ (用K1、K2 表示)
(2)300℃时,在一密闭容器中发生反应:2ClNO(g) 2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
则n=________ ;k=___________ ;达到平衡后,若减小压强,则混合气体的平均分子量将_______ (填“增大”、“减小”或“不变”)。
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08mol NO和0.04mol Cl2发生反应:2NO(g)+Cl2(g) 2ClNO(g) ΔH
2ClNO(g) ΔH
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则ΔH________ 0(填“>”、“<”或“不确定”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图Ⅰ曲线b所示,则改变的条件是___________ 。
②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____ (填“甲”或“乙”);m值为_______________ 。
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+ Cl2(g) | K3 |
则ΔH3=
(2)300℃时,在一密闭容器中发生反应:2ClNO(g)
 2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:序号 | c(ClNO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
则n=
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08mol NO和0.04mol Cl2发生反应:2NO(g)+Cl2(g)
 2ClNO(g) ΔH
2ClNO(g) ΔH①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则ΔH
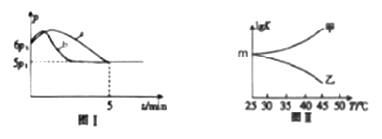
②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是
亚硝酰氯(ClNO)是有机合成中的重要试剂, 工业上可用 NO 与Cl2合成:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及反应的热化学方程式和平衡常数如表:
则Δ H3=___________ (用Δ H1、Δ H2表示); K3=___________ (用 K1、K2表示)。
(2)300℃时,在一密闭容器中发生反应:2ClNO(g) 2NO(g)+Cl2 (g),其正反应速率表达式
2NO(g)+Cl2 (g),其正反应速率表达式 正=k·Cn(ClNO)。测得正反应速率和对应浓度的数据如表:
正=k·Cn(ClNO)。测得正反应速率和对应浓度的数据如表:
则n=___________ ,k=___________ 。
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入 0.08mol NO 和 0.04mol Cl2,发生反应: 2NO(g)+Cl2 (g) 2ClNO(g) Δ H。
2ClNO(g) Δ H。

已知:反应起始和平衡时温度相同。
①测得反应过程中压强(p)随时间(t)的变化如图曲线 a 所示,则Δ H___________ 0(填“>”“<” 或“不确定”);若其他条件相同,仅改变某一条件时,测得压强(p)随时间(t)的变化如图曲线b所示,则改变的条件是___________ 。
②求该温度下反应的压强平衡常数Kp,写出计算过程___________ 。(注:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及反应的热化学方程式和平衡常数如表:
| 反应 | 热化学方程式 | 平衡常数 |
| ① | 2NO2(g)+ NaCl(s) | K1 |
| ② | 4NO2(g)+ 2NaCl(s) | K2 |
| ③ | 2NO(g)+ Cl2(g) | K3 |
(2)300℃时,在一密闭容器中发生反应:2ClNO(g)
| 序号 | c(ClNO)/(mol ·L-1) | |
| ① | 0.30 | 3.60×10−9 |
| ② | 0.60 | 1.44×10−8 |
| ③ | 0.90 | 3.24×10−8 |
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入 0.08mol NO 和 0.04mol Cl2,发生反应: 2NO(g)+Cl2 (g)

已知:反应起始和平衡时温度相同。
①测得反应过程中压强(p)随时间(t)的变化如图曲线 a 所示,则Δ H
②求该温度下反应的压强平衡常数Kp,写出计算过程
工业上可用 与
与 合成亚硝酰氯
合成亚硝酰氯 ,可以用于有机合成。回答下列问题:
,可以用于有机合成。回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及有关反应的热化学方程式如下:
①
②
③
则

__________ (用 、
、 表示)。
表示)。
(2) 时,在一密闭容器中发生反应:
时,在一密闭容器中发生反应: ,其正反应速率表达式
,其正反应速率表达式 。测得正反应速率和对应浓度的数据如表:
。测得正反应速率和对应浓度的数据如表:
则
__________ 达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________ (选填“增大”、“减小”或“不变”)。
(3) 时,向体积为
时,向体积为 且带气压计的恒容密闭容器中通入
且带气压计的恒容密闭容器中通入 和
和 发生反应:
发生反应:
 。已知:反应起始和平衡时温度相同。
。已知:反应起始和平衡时温度相同。
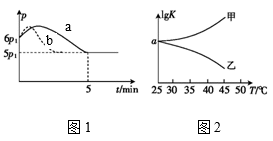
①测得反应过程中压强 随时间
随时间 的变化如图1曲线
的变化如图1曲线 所示,则
所示,则
__________ (选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强 随时间
随时间 的变化如图1曲线
的变化如图1曲线 所示,则改变的条件是
所示,则改变的条件是_________ 。
②图2是两位同学描绘的上述反应平衡常数的对数值 与温度的变化关系图象,其中正确的曲线是
与温度的变化关系图象,其中正确的曲线是______ (选填“甲”或“乙”); 的值为
的值为______ 。
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及有关反应的热化学方程式如下:
①
②
③
则
(2)
| 序号 | ||
| ① | ||
| ② | ||
| ③ |
则
(3)

①测得反应过程中压强
②图2是两位同学描绘的上述反应平衡常数的对数值
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


