解答题-结构与性质 适中0.65 引用2 组卷447
碱金属(Li、Na、K、Rb、Cs)及其化合物在生产、生活中有着重要的应用。
请回答:
(1)基态K原子核外有___________ 种不同的电子运动状态。
(2)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。解释X的熔点比Y高的原因:___________
(3)已知RbH2PO2是次磷酸的正盐,H3PO2的结构式为___________ ,其中P原子采取___________ 杂化方式。
(4)Al、B、H电负性分别为1.5、2.0、2.1,简要说明LiAlH4还原性比NaBH4强的原因:___________
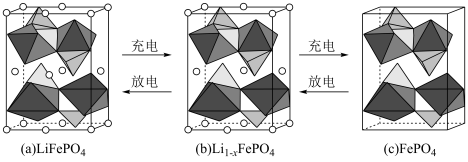
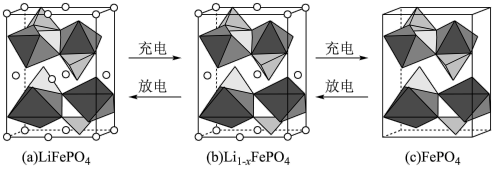
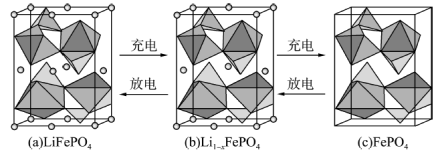
(5)锂离子电池电极材料是LiFePO4,其晶胞结构示意图如①所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体。电池充电时,LiFePO4脱出部分Li+形成Li(1-x)FePO4,其结构示意图如②所示,则Li(1-x)FePO4晶胞中n(Fe2+):n(Fe3+)=_________ 。
请回答:
(1)基态K原子核外有
(2)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。解释X的熔点比Y高的原因:
(3)已知RbH2PO2是次磷酸的正盐,H3PO2的结构式为
(4)Al、B、H电负性分别为1.5、2.0、2.1,简要说明LiAlH4还原性比NaBH4强的原因:
(5)锂离子电池电极材料是LiFePO4,其晶胞结构示意图如①所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体。电池充电时,LiFePO4脱出部分Li+形成Li(1-x)FePO4,其结构示意图如②所示,则Li(1-x)FePO4晶胞中n(Fe2+):n(Fe3+)=

22-23高三下·浙江·阶段练习
类题推荐
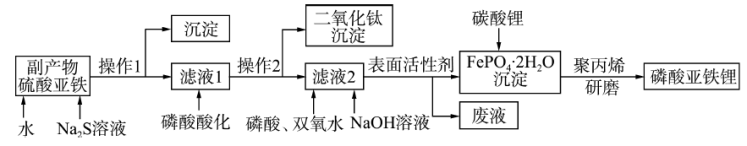
磷酸亚铁锂( )是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
)是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
回答下列问题:
(1)为提高副产物硫酸亚铁浸取速率,除粉碎外,还可以采取的措施是_______ 。
(2)在滤液2中加入磷酸需控制 ,其目的是①提供较强的酸性环境;②
,其目的是①提供较强的酸性环境;②_______ ,聚丙烯的作用是_______ 。
(3)向滤液2中加入NaOH需控制溶液的pH≤2.2,其原因为_______ ;反应生成 的离子方程式为
的离子方程式为_______ 。
(4)已知当溶液中 时视为沉淀完全,又知
时视为沉淀完全,又知 ,
, ,则要使滤液2中铁离子沉淀完全且不生成
,则要使滤液2中铁离子沉淀完全且不生成 沉淀,应控制pH
沉淀,应控制pH_______ [已知 ,
, ]。
]。
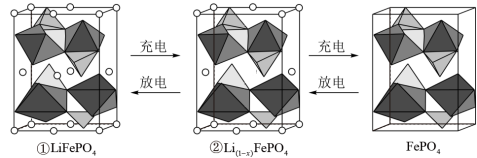
(5) 的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,
的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时, 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=_______ ,
_______ 。
| 物质 | FeS | MnS | CuS | PbS | ZnS |
(1)为提高副产物硫酸亚铁浸取速率,除粉碎外,还可以采取的措施是
(2)在滤液2中加入磷酸需控制
(3)向滤液2中加入NaOH需控制溶液的pH≤2.2,其原因为
(4)已知当溶液中
(5)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网