解答题-结构与性质 较易0.85 引用1 组卷1026
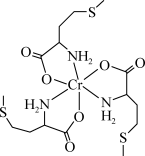
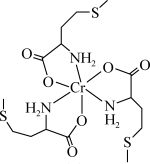
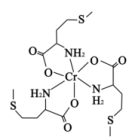
蛋氨酸铬(III)配合物是一种治疗II型糖尿病的药物,其结构简式如图所示。回答下列相关问题:
(1)基态Cr原子核外有_______ 种运动状态的电子,下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是_______ (填标号)。
A.[Ar]3d54s1 B.[Ar]3d5 C.[Ar]3d44s14p1 D.[Ar]3d54p1
(2)蛋氨酸铬(III)配合物的中心铬离子的配位数为_______ ;N的_______ 杂化轨道与Cr的空轨道形成配位键。
(3)哈勃−韦斯(Haber−Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。Cr3+_______ (填“能”或“不能”)催化双氧水分解。
(4)化学式为CrCl3·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,Cr3+的配位数均为6,将它们配制成等体积等物质的量浓度的溶液,分别加入足量AgNO3溶液,依次所得AgCl沉淀的物质的量之比为3:2:1,则呈亮绿色的配合物,其内界离子的化学式为_______ 。H2O分子与Cr3+形成配位键后H−O−H键角_______ (填“变大”“变小”或“不变”)。
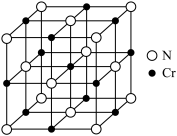
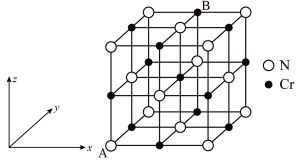
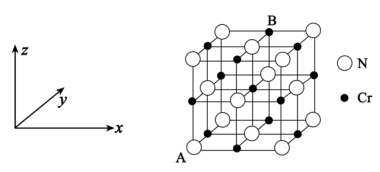
(5)氮化铬的晶体结构类型与氯化钠相似,其晶胞结构如图所示。A点分数坐标为(0,0,0),则B点分数坐标为_______ 。已知氮化铬的晶体密度为dg·cm−3,摩尔质量为M mol∙L−1,NA为阿伏加德罗常数,则晶胞参数为_______ cm(只要求列表达式,不必计算数值)。

(1)基态Cr原子核外有
A.[Ar]3d54s1 B.[Ar]3d5 C.[Ar]3d44s14p1 D.[Ar]3d54p1
(2)蛋氨酸铬(III)配合物的中心铬离子的配位数为
(3)哈勃−韦斯(Haber−Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。Cr3+
(4)化学式为CrCl3·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,Cr3+的配位数均为6,将它们配制成等体积等物质的量浓度的溶液,分别加入足量AgNO3溶液,依次所得AgCl沉淀的物质的量之比为3:2:1,则呈亮绿色的配合物,其内界离子的化学式为
(5)氮化铬的晶体结构类型与氯化钠相似,其晶胞结构如图所示。A点分数坐标为(0,0,0),则B点分数坐标为

2023·四川成都·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网