解答题-原理综合题 适中0.65 引用1 组卷266
氨气是现代工业、农业生产最基础的化工原料之一、
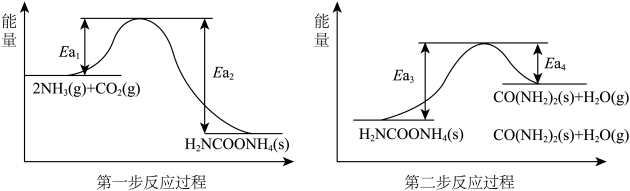
Ⅰ.传统的“哈伯法”反应原理为:

(1)上述反应在常温下___________ (填“能”或“不能”)自发进行。
(2)“哈伯法”合成氨的工业条件为400~500℃、10~30MPa,是综合考虑了___________ 因素(至少写两点)。
(3)t℃时向2L的某刚性容器中充入 和
和 。已知平衡时体系中
。已知平衡时体系中 的体积占比为
的体积占比为 ,则该反应的平衡常数
,则该反应的平衡常数
___________ 。
Ⅱ.“哈伯法”的原料 来自于化石燃料,该过程会产生大量温室气体
来自于化石燃料,该过程会产生大量温室气体 。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
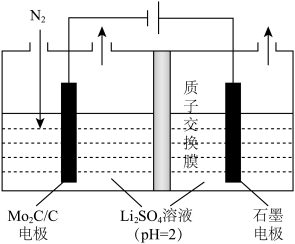
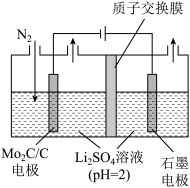
(4)一种常温常压下NRR反应的装置如图所示,请写出阴极的电极反应方程式:___________ 。
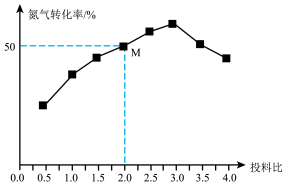
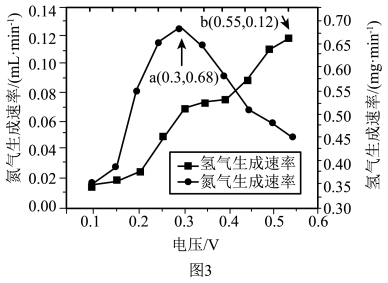
(5)下表为不同电压下进行电解时 电极表面的气体产生情况(以
电极表面的气体产生情况(以 为计算值)
为计算值)
①表中 的最大产率=
的最大产率=___________ (产率=实际产量/理论产量×100%,常温常压下 ,结果保留3位有效数值)
,结果保留3位有效数值)
②较高电压下 的生成速率下降的原因是:
的生成速率下降的原因是:___________ 。
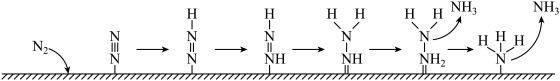
(6)如图为 电极表面“
电极表面“ ”的可能路径(
”的可能路径( 表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:___________ (填化学式)。
Ⅰ.传统的“哈伯法”反应原理为:
(1)上述反应在常温下
(2)“哈伯法”合成氨的工业条件为400~500℃、10~30MPa,是综合考虑了
(3)t℃时向2L的某刚性容器中充入
Ⅱ.“哈伯法”的原料
(4)一种常温常压下NRR反应的装置如图所示,请写出阴极的电极反应方程式:
(5)下表为不同电压下进行电解时
①表中
②较高电压下
| 电压V | |||
| 0.2 | 25 | 0.015 | 0.51 |
| 0.3 | 25 | 0.038 | 0.68 |
| 0.4 | 25 | 0.095 | 0.65 |
| 0.5 | 25 | 0.11 | 0.52 |
(6)如图为
 表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
2023·湖北·二模
类题推荐
哈伯发明用氮气和氢气合成氨的方法,获得了1918年诺贝尔化学奖。其原理为
 ,
,
________ (填“>”“<”或“=”)0。
(1)下列关于工业合成氨的说法不正确的是__________ (填标号)。
A.因为 ,所以该反应一定能自发进行
,所以该反应一定能自发进行
B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是________ (填标号)。
a.容器内 、
、 、
、 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如图:
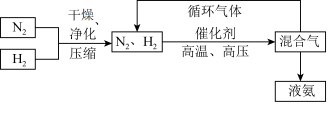
请用平衡移动原理解释在工艺流程中及时分离出氨气和将 分离后的原料气循环使用的原因
分离后的原料气循环使用的原因___________________ 。
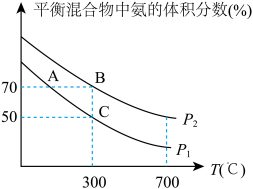
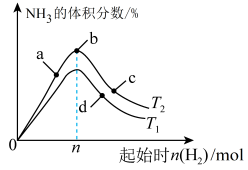
(4)某科研小组研究在其他条件不变的情况下,改变起始时氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示 的物质的量)。
的物质的量)。
①图中 和
和 的关系:
的关系:
________ (填“>”“<”或“=”) 。
。
②a、b、c、d四点所处的平衡状态中, 的转化率最高的是
的转化率最高的是__________ (填字母)。
(5)恒温下,向一个4L的密闭容器中充入5.2mol 和2mol
和2mol ,反应过程中对
,反应过程中对 的浓度进行测定,得到的数据如表所示:
的浓度进行测定,得到的数据如表所示:
①此条件下该反应的化学平衡常数
________ 。
②若维持容器容积不变,温度不变,向原平衡体系中加入 、
、 和
和 各4mol,化学平衡将向
各4mol,化学平衡将向_______ (填“正”或“逆”)反应方向移动。
(6)已知:





写出氨气催化氧化生成NO和水蒸气的热化学方程式________________ 。
(1)下列关于工业合成氨的说法不正确的是
A.因为
B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如图:

请用平衡移动原理解释在工艺流程中及时分离出氨气和将
(4)某科研小组研究在其他条件不变的情况下,改变起始时氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示
①图中
②a、b、c、d四点所处的平衡状态中,

(5)恒温下,向一个4L的密闭容器中充入5.2mol
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②若维持容器容积不变,温度不变,向原平衡体系中加入
(6)已知:
写出氨气催化氧化生成NO和水蒸气的热化学方程式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网