解答题-原理综合题 0.65 引用1 组卷332
落实“双碳”目标,碳资源的综合利用成为重中之重。
I.甲醇不仅是重要的化工原料,还是性能优良的车用燃料。CO2和H2在Cu/ZnO催化作用下可以合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0,此反应分两步进行:
反应i:Cu/ZnO(s)+H2(g)=Cu/Zn(s)+H2O(g) ΔH>0
反应ii:_______ ΔH<0
(1)反应ii的化学反应方程式为_______ 。
(2)在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1:3投料发生该反应,下列不能说明反应已达到平衡的是_______(填字母标号)。
(3)研究表明,用可控Cu/Cu2O界面材料也可催化CO2还原合成甲醇。将6.0molCO2和8.0molH2充入体积为3L的恒温密闭容器中发生此反应。测得起始压强为35MPa,H2的物质的量随时间的变化如图中实线所示。
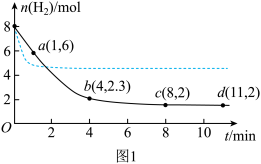
①图1中与实线相比,虚线改变的条件可能是_______ 。
②该反应在0~4min内(实线)H2O的平均反应速率为_______ (保留2位有效数字)。
③该条件下(实线)的Kp为_______ MPa-2。
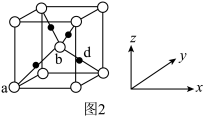
④Cu2O的立方晶胞结构如图2所示。白球代表的是_______ (填“Cu+”或“O2-”);a、b的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d的坐标参数为
),则d的坐标参数为_______ 。
II.在催化剂作用下,用CO脱除NO的反应为:2CO(g)+2NO(g) 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
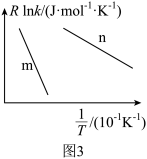
(4)已知Arrhenius经验公式为Rlnk=-Ea/T+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率进行了实验探究,获得如图3曲线。从图中信息获知催化剂的催化效率m_______ n(填“>”“=”或“<”),其理由是_______ 。
I.甲醇不仅是重要的化工原料,还是性能优良的车用燃料。CO2和H2在Cu/ZnO催化作用下可以合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0,此反应分两步进行:
反应i:Cu/ZnO(s)+H2(g)=Cu/Zn(s)+H2O(g) ΔH>0
反应ii:_______ ΔH<0
(1)反应ii的化学反应方程式为
(2)在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1:3投料发生该反应,下列不能说明反应已达到平衡的是_______(填字母标号)。
| A.CO2和H2的转化率相等 |
| B.体系的温度保持不变 |
| C.单位时间体系内减少3molH2的同时有1molH2O增加 |
| D.合成CH3OH的反应限度达到最大 |

①图1中与实线相比,虚线改变的条件可能是
②该反应在0~4min内(实线)H2O的平均反应速率为
③该条件下(实线)的Kp为
④Cu2O的立方晶胞结构如图2所示。白球代表的是

II.在催化剂作用下,用CO脱除NO的反应为:2CO(g)+2NO(g)
(4)已知Arrhenius经验公式为Rlnk=-Ea/T+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率进行了实验探究,获得如图3曲线。从图中信息获知催化剂的催化效率m

2023·山西临汾·一模


