解答题-原理综合题 适中0.65 引用2 组卷990
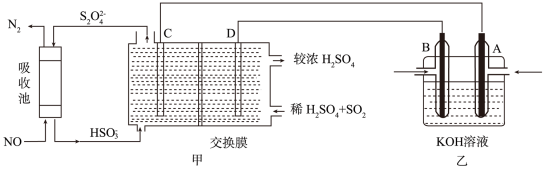
氮及其化合物在工农业生产和生命活动中起着重要的作用。同时,氮氧化物(NOx)是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物(NOx)的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为__________ 。
(2)联氨(又称肼,N2H4,无色液体)也是氮的一种重要的化合物,是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的第一步电离方程式为___________ 。
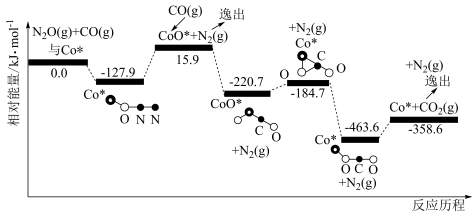
(3)研究氮氧化物(NOx)的无害化处理
I.CO还原NO2的反应原理如下:
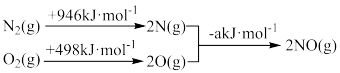
已知:①NO2(g)+CO(g) CO2(g)+NO(g) ΔH1= -234kJ·mol-1
CO2(g)+NO(g) ΔH1= -234kJ·mol-1
②N2(g)+O2(g) 2NO(g) ΔH2= +179.5 kJ·mol-1
2NO(g) ΔH2= +179.5 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) ΔH3=-112.3 kJ·mol-1
2NO2(g) ΔH3=-112.3 kJ·mol-1
NO2与CO反应生成无污染气体的热化学方程式为__________________________ 。
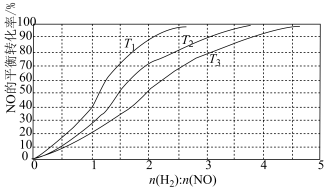
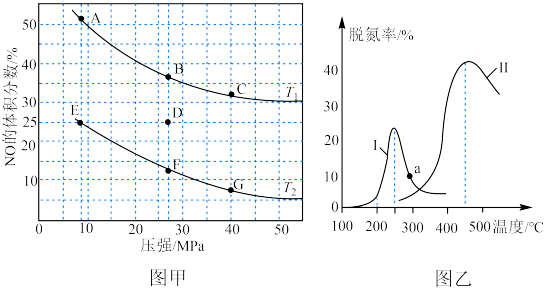
II.用H2还原NO的反应为2H2(g) + 2NO(g) N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
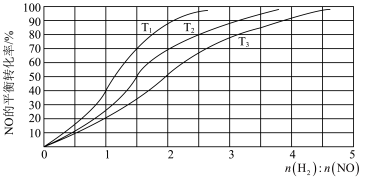
①反应温度T1、T2、T3从高到低的关系为______________________ ;
②T1温度下,充入H2、NO分别为3mol、3mol, 容器内的压强为w Pa,反应进行到10min时达平衡,0~ 10min内N2的平均反应速率为_____________ mol·L-1·s-1,该反应的平衡常数Kp=___________ (写出计算表达式,以分压表示的平衡常数为Kp,某气体分压=总压 ×某气体物质的量分数);
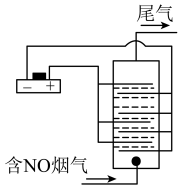
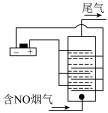
III.以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为
,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为___________________________ (用电极反应和离子方程式表示)
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为
(2)联氨(又称肼,N2H4,无色液体)也是氮的一种重要的化合物,是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的第一步电离方程式为
(3)研究氮氧化物(NOx)的无害化处理
I.CO还原NO2的反应原理如下:
已知:①NO2(g)+CO(g)
②N2(g)+O2(g)
③2NO(g)+O2(g)
NO2与CO反应生成无污染气体的热化学方程式为
II.用H2还原NO的反应为2H2(g) + 2NO(g)

①反应温度T1、T2、T3从高到低的关系为
②T1温度下,充入H2、NO分别为3mol、3mol, 容器内的压强为w Pa,反应进行到10min时达平衡,0~ 10min内N2的平均反应速率为
III.以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为

2023·云南曲靖·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网