解答题-结构与性质 较难0.4 引用2 组卷493
磷是重要的生命元素之一,存在于细胞、蛋白质、骨骼和牙齿中。回答下列问题:
(1)基态P原子核外电子占据的原子轨道数为___________ 。
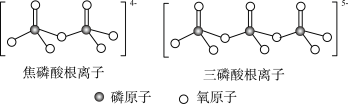
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为___________ ,次磷酸(H3PO2)的结构式为___________ ,次磷酸钠中各元素的电负性由大到小的顺序是___________ ,写出一种与PH3互为等电子体的离子___________ (填微粒符号)。
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是___________ 。
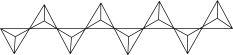
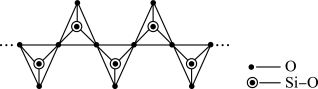
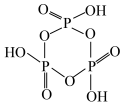
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为___________ (用含n的式子表示)。
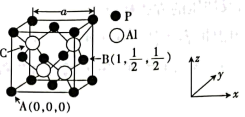
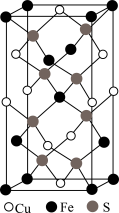
(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为___________ ,已知该晶体的密度为ρg·cm-3,则最近的Al和P原子间的核间距为___________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。

(1)基态P原子核外电子占据的原子轨道数为
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为

(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为

2023·陕西安康·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网