解答题-实验探究题 较难0.4 引用1 组卷334
碳酸钠是一种重要的化工原料,在生产、生活和实验研究中均有广泛应用。下面是与碳酸钠溶液相关问题的探讨,请按要求回答问题。
(1)实验室需配制240 mL 1.5 mol/LNa2CO3溶液,请回答下列问题:
①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有_______ 。
②通过计算可知,该实验需要用托盘天平称量_______ g Na2CO3·10H2O。
③经测定实际配得溶液的浓度为1.4 mol/L,原因不可能_______ (填序号)。
a.转移溶液前容量瓶内有少量蒸馏水 b.定容摇匀后,发现液面下降,继续加水至刻度线
c.转移溶液后未洗涤烧杯 d.定容时俯视刻度线
(2)FeCO3与砂糖混用可以作补血剂,工业上用Na2CO3溶液和FeSO4溶液发生复分解反应制备。(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备 FeCO3沉淀时的具体操作为_______ 。
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也能得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为_______ 。
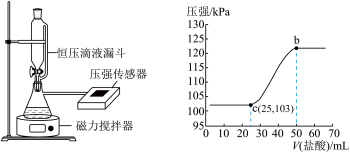
(3)某同学在常温下,向100 mL NaOH溶液中通入一定量的CO2气体制备Na2CO3溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3 mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。请你帮他仔细分析实验结果。
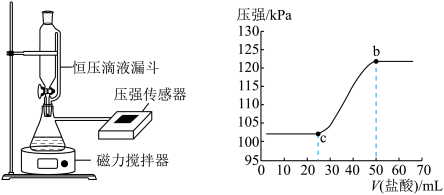
①该同学所得溶液的溶质成分为_______ 。
②该同学使用的NaOH溶液的物质的量浓度不低于_______ mol/L
(1)实验室需配制240 mL 1.5 mol/LNa2CO3溶液,请回答下列问题:
①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有
②通过计算可知,该实验需要用托盘天平称量
③经测定实际配得溶液的浓度为1.4 mol/L,原因不可能
a.转移溶液前容量瓶内有少量蒸馏水 b.定容摇匀后,发现液面下降,继续加水至刻度线
c.转移溶液后未洗涤烧杯 d.定容时俯视刻度线
(2)FeCO3与砂糖混用可以作补血剂,工业上用Na2CO3溶液和FeSO4溶液发生复分解反应制备。(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备 FeCO3沉淀时的具体操作为
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也能得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为
(3)某同学在常温下,向100 mL NaOH溶液中通入一定量的CO2气体制备Na2CO3溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3 mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。请你帮他仔细分析实验结果。

①该同学所得溶液的溶质成分为
②该同学使用的NaOH溶液的物质的量浓度不低于
22-23高一上·黑龙江大庆·期末
知识点:氢氧化钠、碳酸钠混合溶液与盐酸反应相关考查碳酸钠、碳酸氢钠混合物的有关求算配制一定物质的量浓度溶液的综合考查常见无机物的制备 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网