计算题 较难0.4 引用1 组卷157
工业废水中常含有一定量的 ,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为
转化为 ,再将
,再将 转化为
转化为 沉淀。
沉淀。
(1) 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 的酸式电离方程式:
的酸式电离方程式:_____ 。
(2) 在强碱中可被双氧水氧化为
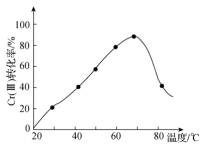
在强碱中可被双氧水氧化为 ,控制其他条件不变,反应温度对
,控制其他条件不变,反应温度对 转化率的影响如图所示。请分析温度超过70℃时,
转化率的影响如图所示。请分析温度超过70℃时, 转化率下降的原因是
转化率下降的原因是_______ 。
(3)溶液中的 与强碱性溶液反应,使
与强碱性溶液反应,使 完全沉淀的
完全沉淀的 为
为_______ {通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全; 的
的 ,
, ,
, }。
}。
(4)25℃时,将 的醋酸与
的醋酸与 氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为_______ 。
(5)标准状况下,将 通入
通入 的
的 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
_______ 。
(1)
(2)

(3)溶液中的
(4)25℃时,将
(5)标准状况下,将
22-23高二下·甘肃张掖·阶段练习
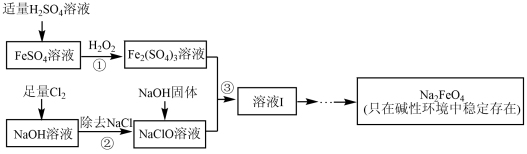
 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
 ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO

