解答题-工业流程题 适中0.65 引用2 组卷396
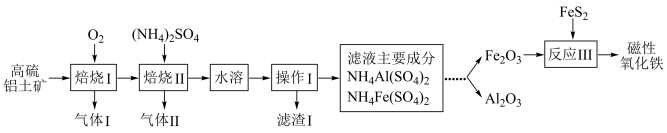
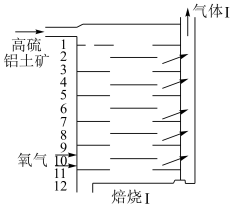
磁性氧化铁是电讯器材的重要原料,以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)提取氧化铝和磁性氧化铁的流程如图:
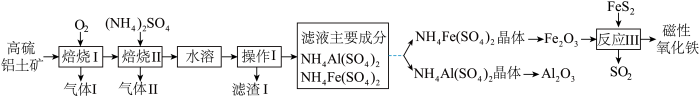
已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100gH2O)如表:
(1)气体I中的成分中除氧气外,还有______ 。
(2)写出“焙烧II”中Fe2O3发生的化学反应方程式______ 。
(3)写出滤渣I主要成分的一种用途______ 。
(4)从滤液中获得NH4Al(SO4)2的操作是______ 。
(5)“反应III”在隔绝空气条件下进行,参与反应的n(FeS2):n(Fe2O3)=______ 。
(6)该工业流程中有多种气体产生,将它们综合利用可合成流程中的某种反应物,该合成总反应的化学方程式为______ 。
(7)为测定Al2O3产品的纯度(Al2O3的质量分数),称量mg样品溶解于足量稀硫酸,配成100.00mL溶液,取出20.00mL溶液,加入c1mol•L-1EDTA标准溶液V1mL,调节溶液pH并煮沸,冷却后用c2mol•L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V2mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1:1)。则制得的Al2O3的纯度为______ (用代数式表示)。

已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100gH2O)如表:
| 温度/℃ | 0 | 20 | 30 | 40 | 100 |
| NH4Fe(SO4)2 | 70.6 | 75.4 | 78.3 | 81.0 | 102.1 |
| NH4Al(SO4)2 | 2.1 | 5.0 | 7.7 | 10.9 | 26.7 |
(2)写出“焙烧II”中Fe2O3发生的化学反应方程式
(3)写出滤渣I主要成分的一种用途
(4)从滤液中获得NH4Al(SO4)2的操作是
(5)“反应III”在隔绝空气条件下进行,参与反应的n(FeS2):n(Fe2O3)=
(6)该工业流程中有多种气体产生,将它们综合利用可合成流程中的某种反应物,该合成总反应的化学方程式为
(7)为测定Al2O3产品的纯度(Al2O3的质量分数),称量mg样品溶解于足量稀硫酸,配成100.00mL溶液,取出20.00mL溶液,加入c1mol•L-1EDTA标准溶液V1mL,调节溶液pH并煮沸,冷却后用c2mol•L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V2mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1:1)。则制得的Al2O3的纯度为
2023·福建龙岩·模拟预测
类题推荐
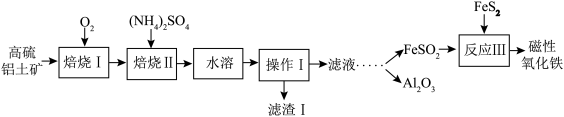
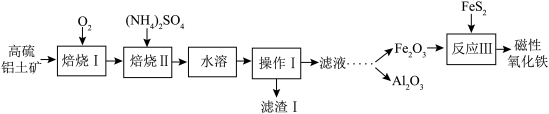
某地以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)为原料提取氧化铝和磁性氧化铁,用直接碱溶法往往会因形成铝硅酸钠沉淀[NamAlmSinO16(OH)5]而造成铝损失。一种改进后的流程如下:_____ ;NamAlmSinO16(OH)5中的m和n之间的关系式为_____ ;
(2)写出滤渣I主要成分的一种用途:_____ ;
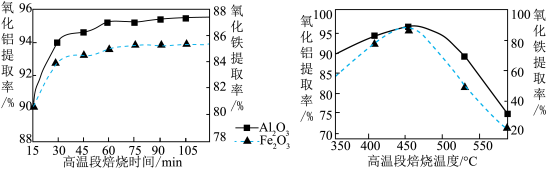
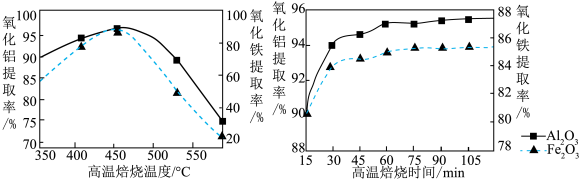
(3)“焙烧Ⅱ”的过程是由氧化铝、氧化铁制得可溶性的NH4Al(SO4) 2、NH4Fe(SO4)2.提取率随温度、时间的变化曲线如图所示,最佳的焙烧时间与温度是_____ 。若用NH4R(SO4) 2表示NH4Al(SO4) 2、NH4Fe(SO4) 2,则相关反应的化学方程式为_____ 。
(5)为了测定Wg高硫铝土矿中铝元素的含量,将流程中制取的Al2O3溶解于足量稀硫酸中,配制成250mL溶液,取出25mL,加入amLcmol·L-1EDTA标准溶液,调节溶液pH约为4.2,煮沸,冷却后用bmol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液VmL(已知Al3+、Cu2+与EDTA反应的化学计量数之比均为1:1)。则Wg高硫铝土矿中铝元素的质量分数为_____ (用含V、a、b、c的代数式表示)
(2)写出滤渣I主要成分的一种用途:
(3)“焙烧Ⅱ”的过程是由氧化铝、氧化铁制得可溶性的NH4Al(SO4) 2、NH4Fe(SO4)2.提取率随温度、时间的变化曲线如图所示,最佳的焙烧时间与温度是
| A.因为原子半径:Na>S,所以离子半径:Na+>S2- |
| B.因为非金属性:S>Si,所以气态氢化物的稳定性:SiH4<H2S |
| C.因为非金属性:O>S,所以沸点:H2S>H2O |
| D.因为金属性:Na>Al,所以碱性:NaOH>Al(OH)3 |
(5)为了测定Wg高硫铝土矿中铝元素的含量,将流程中制取的Al2O3溶解于足量稀硫酸中,配制成250mL溶液,取出25mL,加入amLcmol·L-1EDTA标准溶液,调节溶液pH约为4.2,煮沸,冷却后用bmol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液VmL(已知Al3+、Cu2+与EDTA反应的化学计量数之比均为1:1)。则Wg高硫铝土矿中铝元素的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网