解答题-原理综合题 较难0.4 引用2 组卷262
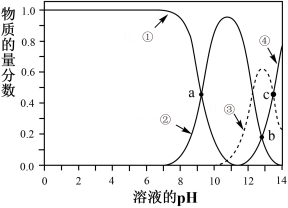
I.亚砷酸(H3AsO3)可以用作防腐剂、杀虫剂和除草剂,H3AsO3是三元弱酸,在溶液中存在多种含砷微粒。25℃时各种微粒物质的量分数与溶液pH的关系如图所示,其中a点横坐标值为9.3。回答下列问题。
(1)曲线②代表的含砷微粒是________ 。
(2)将NaOH溶液滴加到H3AsO3溶液中,当pH从12调至13时,发生的主要反应的离子方程式是_________________________ 。
(3)将Na3AsO3和NaH2AsO3固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足3c(Na+)=7[c(AsO )+c(HAsO
)+c(HAsO )+c(H2AsO
)+c(H2AsO )+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为
)+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为_______________ 。
(4)25℃,当c(H3AsO3)=c(HAsO )时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
)时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为_____________ 。
Ⅱ.用NaOH溶液吸收烟气中的SO2气体,将所得的Na2SO3溶液进行电解,可实现NaOH溶液的循环再生,同时得到H2SO4,以石墨为电极的电解装置如图。
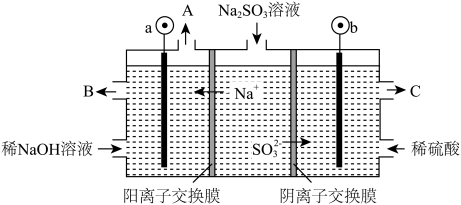
(5)Na2SO3溶液所有阴离子浓度由大到小的顺序为_____________ 。
(6)图中a极连接电源的__________ 极。
(7)b电极电极反应式为_________________ 。
Ⅲ.
(8)含铬废水中的CrO 可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于
可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于_______ mol/L。

(1)曲线②代表的含砷微粒是
(2)将NaOH溶液滴加到H3AsO3溶液中,当pH从12调至13时,发生的主要反应的离子方程式是
(3)将Na3AsO3和NaH2AsO3固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足3c(Na+)=7[c(AsO
(4)25℃,当c(H3AsO3)=c(HAsO
Ⅱ.用NaOH溶液吸收烟气中的SO2气体,将所得的Na2SO3溶液进行电解,可实现NaOH溶液的循环再生,同时得到H2SO4,以石墨为电极的电解装置如图。

(5)Na2SO3溶液所有阴离子浓度由大到小的顺序为
(6)图中a极连接电源的
(7)b电极电极反应式为
Ⅲ.
(8)含铬废水中的CrO
22-23高二上·广东深圳·期末
知识点:电离平衡常数及影响因素盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理电解原理的理解及判断电解池电极反应式及化学方程式的书写与判断 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如表:
①常温下,浓度相同的三种溶液NaF、Na2CO3、CH3COONa,pH由大到小的顺序是____ 。
②将过量H2S通入Na2CO3溶液,反应的离子方程式____ 。
(2)室温下,用0.100mol·L-1盐酸溶液滴定20.00mL0.100mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①、②填“>”“<”或“=”)。
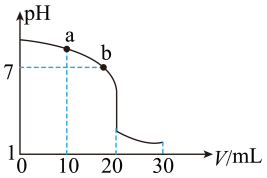
①a点所示的溶液中c(NH3·H2O)____ c(Cl-)。
②b点所示的溶液中c(Cl-)____ c(NH )。
)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为___ 。
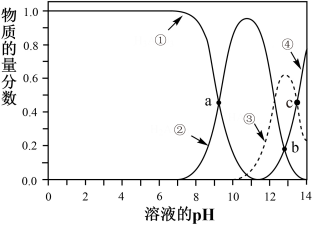
(3)雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示:

①人体血液的pH在7.35-7.45之间,用药后人体中含砷元素的主要微粒是____ 。
②将KOH溶液滴入亚砷酸溶液,当pH调至11时发生反应的离子方程式是____ 。
③下列说法正确的是___ (填字母序号)
a.n(H3AsO3):n(H2AsO )=1:1时,溶液显碱性
)=1:1时,溶液显碱性
b.pH=12时,溶液中c(H2AsO )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)
c.在K3AsO3溶液中,c(AsO )>c(HAsO
)>c(HAsO )>c(H2AsO
)>c(H2AsO )
)
(1)已知部分弱酸的电离常数如表:
| 弱酸 | HF | CH3COOH | H2CO3 | H2S |
| 电离平衡常(25℃) | Ka=7.2×10-4 | Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
②将过量H2S通入Na2CO3溶液,反应的离子方程式
(2)室温下,用0.100mol·L-1盐酸溶液滴定20.00mL0.100mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①、②填“>”“<”或“=”)。

①a点所示的溶液中c(NH3·H2O)
②b点所示的溶液中c(Cl-)
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为
(3)雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示:

①人体血液的pH在7.35-7.45之间,用药后人体中含砷元素的主要微粒是
②将KOH溶液滴入亚砷酸溶液,当pH调至11时发生反应的离子方程式是
③下列说法正确的是
a.n(H3AsO3):n(H2AsO
b.pH=12时,溶液中c(H2AsO
c.在K3AsO3溶液中,c(AsO
研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①写出H2S的Ka1的表达式:________________ 。
②常温下,浓度相同的三种溶液NaF、Na2CO3、CH3COONa,pH由大到小的顺序是___________ 。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________________________ 。
(2)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.100 mol·L-1的氨水溶液,滴定曲线如图所示。
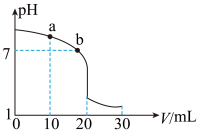
(忽略溶液体积的变化,①②填“>”“<”或“=”)
①a点所示的溶液中c (NH3·H2O)___________ c (Cl-)。
②b点所示的溶液中c (Cl-)___________ c (NH )。
)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c (H+)之比为__________ 。
(3)雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH 关系如下图所示:
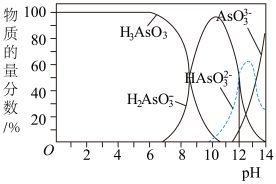
①人体血液的pH在7.35 -7.45之间,用药后人体中含砷元素的主要微粒是_________ 。
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11 时发生反应的离子方程式是_________ 。
③下列说法正确的是_________ (填字母序号)
a.n(H3AsO3)∶n(H2AsO )=1∶1时,溶液显碱性
)=1∶1时,溶液显碱性
b.pH=12时,溶液中c(H2AsO )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)
c.在K3AsO3溶液中,c(AsO )>c(HAsO
)>c(HAsO )>c(H2AsO
)>c(H2AsO )
)
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HF | CH3COOH | H2CO3 | H2S |
| 电离平衡常数(25℃) | Ka=7.2×10-4 | Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
②常温下,浓度相同的三种溶液NaF、Na2CO3、CH3COONa,pH由大到小的顺序是
③将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.100 mol·L-1的氨水溶液,滴定曲线如图所示。

(忽略溶液体积的变化,①②填“>”“<”或“=”)
①a点所示的溶液中c (NH3·H2O)
②b点所示的溶液中c (Cl-)
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c (H+)之比为
(3)雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH 关系如下图所示:

①人体血液的pH在7.35 -7.45之间,用药后人体中含砷元素的主要微粒是
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11 时发生反应的离子方程式是
③下列说法正确的是
a.n(H3AsO3)∶n(H2AsO
b.pH=12时,溶液中c(H2AsO
c.在K3AsO3溶液中,c(AsO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网