解答题-原理综合题 适中0.65 引用1 组卷54
煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
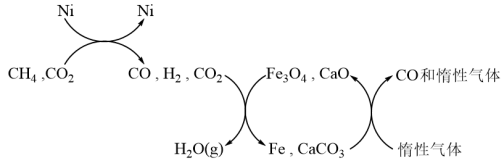
Ⅰ.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应① ,而在水气变换装置中发生反应②
,而在水气变换装置中发生反应② 。
。
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_______ 。
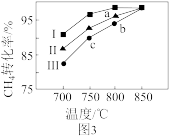
(2)如图表示发生反应①后进入反应②装置的 与反应②中
与反应②中 平衡转化率、温度的变化关系。
平衡转化率、温度的变化关系。
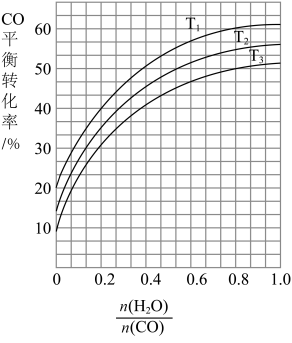
若 为0.8,一定量的煤和水蒸气经反应①和反应②后,得到
为0.8,一定量的煤和水蒸气经反应①和反应②后,得到 与
与 的物质的量之比为1∶3,则反应②所对应的温度是
的物质的量之比为1∶3,则反应②所对应的温度是_______ (填“ ”“
”“ ”或“
”或“ ”)。
”)。
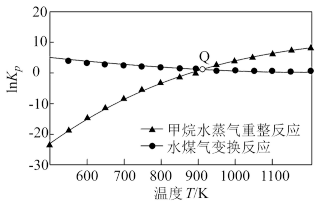
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气( 和
和 的混合气体)。现在常见的重整技术有甲烷—二氧化碳重整、甲烷—水蒸气重整,其反应分别为
的混合气体)。现在常见的重整技术有甲烷—二氧化碳重整、甲烷—水蒸气重整,其反应分别为 、
、 。
。
(3)通过计算机模拟甲烷—水蒸气重整实验测得,在操作压强为 、水碳比
、水碳比 为1.0、温度为
为1.0、温度为 ,反应达到平衡时,
,反应达到平衡时, 的物质的量分数为0.6,已知该反应的速率方程
的物质的量分数为0.6,已知该反应的速率方程 ,式中k为速率常数,p为气体分压(气体分压=总压×气体物质的量分数),则此时该反应速率
,式中k为速率常数,p为气体分压(气体分压=总压×气体物质的量分数),则此时该反应速率
_______ (用含k的式子表示); 时,该反应的压强平衡常数
时,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度计算)。
Ⅰ.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:
(2)如图表示发生反应①后进入反应②装置的

若
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(
(3)通过计算机模拟甲烷—水蒸气重整实验测得,在操作压强为
2023高三·全国·专题练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




 CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题: