解答题-实验探究题 适中0.65 引用3 组卷813
碳酸锰( )用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为
)用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 ,过程如下(部分操作和条件略)。已知:
,过程如下(部分操作和条件略)。已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化; 。回答下列问题:
。回答下列问题:
(1)制备 溶液:m g软锰矿粉经除杂后制得
溶液:m g软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如下图所示(夹持和加热装置略)。
溶液,实验装置如下图所示(夹持和加热装置略)。
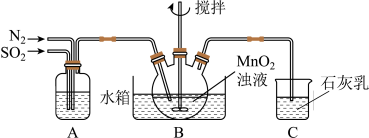
通过装置A可观察通入 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是_______ ;为使 尽可能转化完全,在停止实验前应进行的操作是
尽可能转化完全,在停止实验前应进行的操作是_______ ; 转化为
转化为 的离子方程式为
的离子方程式为_______ 。实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是_______ 。
(2)制备 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到
溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到 固体。若用同浓度的
固体。若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有_______ (填化学式);用乙醇洗涤的目的是_______ 。
(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使 完全转化为
完全转化为 (其中
(其中 完全转化为
完全转化为 ),除去多余的硝酸,加入稍过量的硫酸铵除去
),除去多余的硝酸,加入稍过量的硫酸铵除去 ,加入稀硫酸酸化,再用
,加入稀硫酸酸化,再用 硫酸亚铁铵标准溶液滴定,发生反应
硫酸亚铁铵标准溶液滴定,发生反应 ,消耗标准液的体积平均为
,消耗标准液的体积平均为 mL;用
mL;用 mL
mL  酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。软锰矿中锰元素的质量分数为
。软锰矿中锰元素的质量分数为_______ (用m,c,V的式子表示);用硫酸亚铁铵标准溶液滴定时,下列操作会使锰元素的质量分数偏大的是_______ (填标号)。
A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
(1)制备

通过装置A可观察通入
(2)制备
(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使
A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
2023·山东菏泽·一模
类题推荐
高纯碳酸锰广泛应用于电子工业,是制备高性能磁性材料的原料。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 。回答下列问题:
。回答下列问题:
(1)制备 溶液:将
溶液:将 软锰矿粉经除杂后制得
软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如图所示(夹持和加热装置略)。
溶液,实验装置如图所示(夹持和加热装置略)。
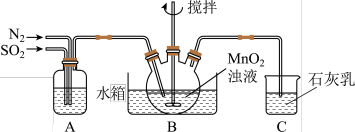
①通过装置A可观察通入 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是___________ 。
② 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
③实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是___________ 。
(2)制备 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成
溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成 的离子方程式为
的离子方程式为___________ 。检验沉淀是否洗涤干净的方法是___________ 。
(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,加热后,立即加入1g硝酸铵,充分反应后,碳酸锰全部转化为 ,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用
,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用 的硫酸亚铁铵[
的硫酸亚铁铵[ ]标准溶液滴定[反应为
]标准溶液滴定[反应为 ]。重复操作3次,记录数据如表:
]。重复操作3次,记录数据如表:
则产品的纯度为___________ 。若滴定终点时俯视读数,则测得的碳酸锰产品的纯度___________ (填“偏高”“偏低”或“无影响”)。
(1)制备

①通过装置A可观察通入
②
③实验中若将
(2)制备
(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,加热后,立即加入1g硝酸铵,充分反应后,碳酸锰全部转化为
| 滴定次数 | ||
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 10.20 |
| 2 | 0.22 | 11.32 |
| 3 | 1.05 | 10.95 |
高纯碳酸锰广泛应用于电子工业,是制备高性能磁性材料的原料。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 。回答下列问题:
。回答下列问题:
(1)制备 溶液:将mg软锰矿粉经除杂后制得
溶液:将mg软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如图所示(夹持和加热装置略)。
溶液,实验装置如图所示(夹持和加热装置略)。
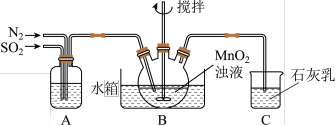
①通过装置A可观察通入: 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是____________ ;
②装置C的作用是______ ;
③ 转化为
转化为 的离子方程式为
的离子方程式为____________ ;
④实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 ,浓度,原因是
,浓度,原因是____________ 。
(2)制备 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成
溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成 的离子方程式为
的离子方程式为______ 。检验沉淀是否洗涤干净的方法是______ 。
(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,加热后,立即加入1g硝酸铵,充分反应后,碳酸锰全部转化为 ,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用0.1000 mol⋅L
,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用0.1000 mol⋅L 的硫酸亚铁铵
的硫酸亚铁铵 标准溶液滴定[反应为
标准溶液滴定[反应为 ],重复操作3次,记录数据如表:(已知:
],重复操作3次,记录数据如表:(已知: 的摩尔质量为115g/mol)
的摩尔质量为115g/mol)
则产品的纯度为______ 。若滴定终点时仰视读数,则测得的碳酸锰产品的纯度______ (填“偏高”“偏低”或“无影响”)。
(1)制备

①通过装置A可观察通入:
②装置C的作用是
③
④实验中若将
(2)制备
(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,加热后,立即加入1g硝酸铵,充分反应后,碳酸锰全部转化为
滴定次数 | 0.1000 mol⋅L | |
滴定前 | 滴定后 | |
1 | 1.15 | 11.05 |
2 | 0.12 | 11.42 |
3 | 0.30 | 10.40 |
高纯MnCO3广泛应用于电子工业,是制备高性能磁性材料的主要原料。某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质主要为铁的化合物)制备高纯碳酸锰。回答下列问题:
(1)制备MnSO4溶液:将mg软锰矿粉与水混合制得MnO2浊液,向MnO2浊液中通入SO2,制得MnSO4溶液,实验装置如图所示(夹持和加热装置略):
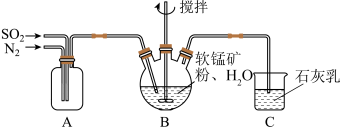
①通过装置A可观察SO2和N2的通入速率,则A中加入的最佳试剂是________ 。
②通入过量SO2和N2的混合气进行“浸锰”操作,B中发生反应的离子方程式为________ 。
③“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图。为减少MnS2O6的生成,“浸锰”过程适宜的温度是________ 。

④“浸锰”结束后,向B中加入一定量MnO2粉末,调节pH到3.8左右过滤,即可获得MnSO4溶液。查阅表格,回答加入一定量MnO2粉末的主要作用是________ 。
(2)制备MnCO3固体:在搅拌下向MnSO4溶液中缓慢滴加NH4HCO3溶液,经过滤、洗涤、干燥,得到高纯碳酸锰,生成MnCO3的离子方程式为_______ 。已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解,选择用C2H5OH洗涤的原因是________ 。检验沉淀是否洗涤干净的操作是_______ 。
(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,在空气中加热充分反应,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50mL,滴加2~3滴指示剂,然后用浓度为0.2000mol•L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定{反应方程式为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO }。重复操作3次,记录数据如表:
}。重复操作3次,记录数据如表:
则产品的纯度=_______ (保留四位有效数字)。
(1)制备MnSO4溶液:将mg软锰矿粉与水混合制得MnO2浊液,向MnO2浊液中通入SO2,制得MnSO4溶液,实验装置如图所示(夹持和加热装置略):

①通过装置A可观察SO2和N2的通入速率,则A中加入的最佳试剂是
②通入过量SO2和N2的混合气进行“浸锰”操作,B中发生反应的离子方程式为
③“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图。为减少MnS2O6的生成,“浸锰”过程适宜的温度是

④“浸锰”结束后,向B中加入一定量MnO2粉末,调节pH到3.8左右过滤,即可获得MnSO4溶液。查阅表格,回答加入一定量MnO2粉末的主要作用是
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,在空气中加热充分反应,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50mL,滴加2~3滴指示剂,然后用浓度为0.2000mol•L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定{反应方程式为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO
| 滴定 | 0.2000mol•L-1的硫酸亚铁铵标准溶液读数(mL) | |
| 次数 | 滴定前 | 滴定后 |
| 1 | 0.10 | 10.11 |
| 2 | 0.22 | 10.22 |
| 3 | 0.05 | 10.04 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


