解答题-原理综合题 适中0.65 引用1 组卷232
(1)人体血液中存在平衡
(2)利用
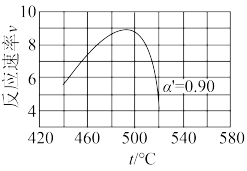
①下列说法正确的是
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol
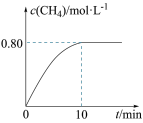
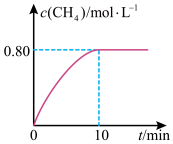
②从反应开始到10min,
③300℃时,反应的平衡常数K=
④500℃该反应达到平衡时,上述容器中有1.6mol
则
(3)化工废水中常常含有以二甲胺(
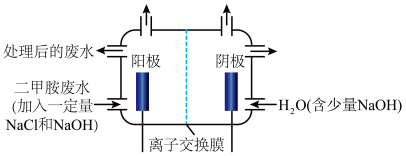
反应原理是:(i)
(ii)
(iii)
①写出电解池中阴极发生反应的方程式
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是
③当阴极区收集到6.72L(标况下)
22-23高二上·重庆铜梁·期末
类题推荐
研究氮的相关化合物在化工生产中有重要意义
(1)反应 ,可有效降低汽车尾气污染物的排放.一定条件下该反应经历三个反应阶段,反应历程如图所示,三个反应中,属于吸热反应的是反应
,可有效降低汽车尾气污染物的排放.一定条件下该反应经历三个反应阶段,反应历程如图所示,三个反应中,属于吸热反应的是反应_______ (填“①”“②”或“③”),图中
_______ 
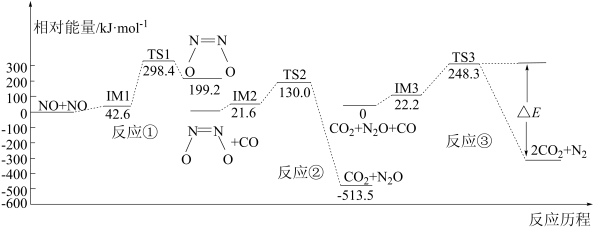
(2)硝化反应是最普遍和最早发现的有机反应之一,以 为新型硝化剂的反应具有反应条件温和、反应速度快、选择性高、无副反应发生、过程无污染等优点,可利用
为新型硝化剂的反应具有反应条件温和、反应速度快、选择性高、无副反应发生、过程无污染等优点,可利用 臭氧化法制备
臭氧化法制备 ,其反应为
,其反应为 ,在恒温恒压条件下,下列说法能够说明该反应已经达到平衡的是_______(填序号)(不考虑其他反应干扰)
,在恒温恒压条件下,下列说法能够说明该反应已经达到平衡的是_______(填序号)(不考虑其他反应干扰)
(3)在密闭容器中充入 和
和 ,发生反应
,发生反应 ,平衡时
,平衡时 在容器内的体积分数
在容器内的体积分数 随温度变化的曲线如图甲所示【要考虑反应
随温度变化的曲线如图甲所示【要考虑反应 】
】
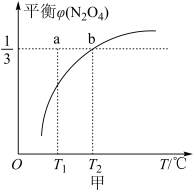
①a点的
_______  (填“>”“<”或“=”).
(填“>”“<”或“=”).
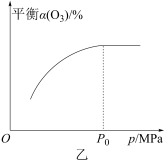
②对反应体系加压,得平衡时 的转化率
的转化率 与压强的关系如图乙所示,请解释压强增大至
与压强的关系如图乙所示,请解释压强增大至 的过程中
的过程中 逐渐增大的原因:
逐渐增大的原因:_______
③图甲中, 时,平衡后总压为
时,平衡后总压为 ,
, 和
和 的平衡分压相同,则反应
的平衡分压相同,则反应 以压强表示的平衡常数
以压强表示的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)化工废水中常常含有以二甲胺 为代表的含氮有机物,用电解法将二甲胺转化为无毒无害的气体排放,装置如图所示,反应原理是①
为代表的含氮有机物,用电解法将二甲胺转化为无毒无害的气体排放,装置如图所示,反应原理是① 在阳极转化为
在阳极转化为 ;②
;② 在碱性溶液中歧化为
在碱性溶液中歧化为 ;③
;③ 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和
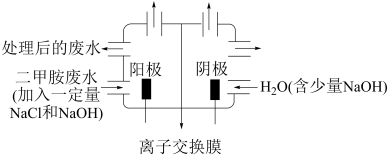
①写出电解池中阴极发生反应的化学方程式:_______
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是_______
③当阴极区收集到 (标况下)气体时,阳极区收集到N2的体积(标况下)是
(标况下)气体时,阳极区收集到N2的体积(标况下)是_______ mL
(1)反应

(2)硝化反应是最普遍和最早发现的有机反应之一,以
| A.混合气体密度不再改变 |
| B.消耗 |
| C. |
| D.混合气体的平均相对分子质量不再改变 |

①a点的
②对反应体系加压,得平衡时

③图甲中,
(4)化工废水中常常含有以二甲胺

①写出电解池中阴极发生反应的化学方程式:
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是
③当阴极区收集到
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网