解答题-工业流程题 适中0.65 引用1 组卷108
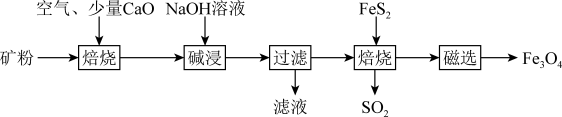
聚合硫酸铁是一种常用净水剂,其分子式可表示为 。以工业废铁屑(含少量
。以工业废铁屑(含少量 、FeS)为原料制取聚合硫酸铁的工艺流程如图1所示。
、FeS)为原料制取聚合硫酸铁的工艺流程如图1所示。
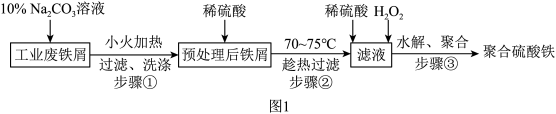
已知:硫酸亚铁的溶解度如表所示。
回答下列问题:
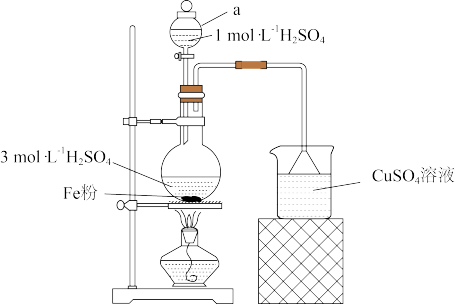
(1)步骤②将预处理后铁屑转移至三颈烧瓶,加入适量3mol·L
 溶液,水浴加热至70~75℃,直到不再有气泡产生。装置如图2所示。
溶液,水浴加热至70~75℃,直到不再有气泡产生。装置如图2所示。
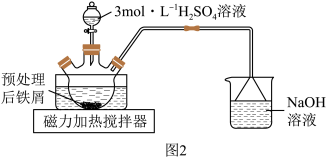
盛放3mol·L
 溶液的仪器名称为
溶液的仪器名称为___________ 。装置中用到的热源是磁力加热搅拌器,不宜使用酒精灯,是因为___________ 。
(2)步骤②趁热过滤所得的滤渣的主要成分为___________ (填化学式);过滤需要趁热的原因是___________ 。
(3)向步骤②所得滤液中滴加几滴KSCN溶液,无明显现象,是因为___________ (用离子方程式表示)。
(4)向滤液中滴加少量稀硫酸,分批加入 ,边加边搅拌,直到出现少量气泡。滤液中开始时发生反应的离子方程式为
,边加边搅拌,直到出现少量气泡。滤液中开始时发生反应的离子方程式为___________ 。后期出现少量气泡的原因是___________ (用化学方程式表示),收集该气体的装置为___________ (填标号)。
(5)经上述处理后的溶液先水解后聚合得到红棕色黏稠液体即聚合硫酸铁,则水解产生 的化学方程式为
的化学方程式为___________ 。

已知:硫酸亚铁的溶解度如表所示。
| T/℃ | 10 | 20 | 30 | 40 | 50 |
| S/g | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
回答下列问题:
(1)步骤②将预处理后铁屑转移至三颈烧瓶,加入适量3mol·L

盛放3mol·L
(2)步骤②趁热过滤所得的滤渣的主要成分为
(3)向步骤②所得滤液中滴加几滴KSCN溶液,无明显现象,是因为
(4)向滤液中滴加少量稀硫酸,分批加入

(5)经上述处理后的溶液先水解后聚合得到红棕色黏稠液体即聚合硫酸铁,则水解产生
2023高三·全国·专题练习
类题推荐
某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol/L的硫酸,连接好装置(如图)后水浴加热至反应完全。
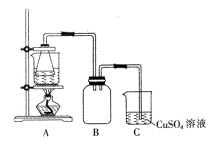
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________ 。
(3)装置C的作用是_____________ 。
(4)步骤④中洗涤时所用的洗涤剂最好是_____________ 。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后cmol/L的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
滴定过程中发生反应的离子方程式为________ ;产品的纯度为_________ (列出计算表达式即可)。
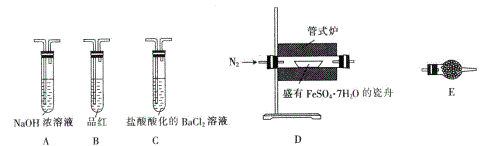
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol/L的硫酸,连接好装置(如图)后水浴加热至反应完全。

③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是
(3)装置C的作用是
(4)步骤④中洗涤时所用的洗涤剂最好是
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后cmol/L的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
滴定过程中发生反应的离子方程式为
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:

| 操作步骤 | 实验现象 | 解释原因 |
| 组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
| 气体产物经过试管B时 | 品红溶液褪色 | (6) |
| 气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 |
| 将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8) | (9) |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网