解答题-工业流程题 适中0.65 引用1 组卷160
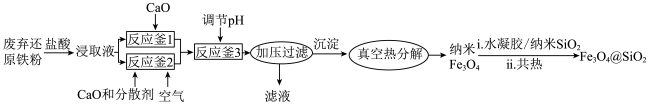
纳米 是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含
是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含 )为原料制备,实现变废为宝,路线如下:
)为原料制备,实现变废为宝,路线如下:
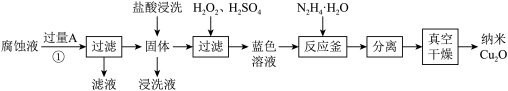
已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b. 中的
中的 元素为
元素为 价。
价。
请回答下列问题
(1)流程中的 为
为_______ (填化学式),①发生的反应的离子方程式为_______ ;
(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是_______ ;
(3)为验证“反应釜”中反应已发生,可采用的实验操作是_______ ,从反应体系中分离出分散质_______ (填“能”或“不能”)选择过滤操作,理由是_______ ;
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况_______ ;

已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b.
请回答下列问题
(1)流程中的
(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是
(3)为验证“反应釜”中反应已发生,可采用的实验操作是
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况
22-23高一上·辽宁鞍山·期末
类题推荐
常温下 是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有
是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有 、
、 ,次要成分有
,次要成分有 、
、 、
、 、
、 )和萤石(主要成分为
)和萤石(主要成分为 ,含微量二氧化硅、硫单质)为原料制备
,含微量二氧化硅、硫单质)为原料制备 的流程如图所示:
的流程如图所示:

已知:① 溶液在“热溶浸”中,只能溶解
溶液在“热溶浸”中,只能溶解 ;
;
②室温下,溶液 时,
时, 的溶解度为
的溶解度为 ;
;
③相关金属离子形成氢氧化物沉淀的 范围如下表所示:
范围如下表所示:
回答下列问题:
(1)产生的气体A是______ ;“热溶浸”时,下列措施能提高硼元素浸出率的有______ (填序号)。
a.粉碎矿石 b.适当升高“热溶浸”温度
c.适当缩短“热溶浸”时间 d.加快搅拌速度
(2)已知硼酸在水中的电离方程式为 。室温下,调节过滤1所得滤液的
。室温下,调节过滤1所得滤液的 值为4,析出硼酸固体,则滤液2中
值为4,析出硼酸固体,则滤液2中
_________  。
。
(3)补充完整反应釜中发生主要反应的化学方程式:① ;②
;②___________ ;过量浓硫酸的作用是___________ (答出2点)。
(4)根据下表,选择反应釜中的最佳反应条件:温度为________ ,硫酸质量分数为________ 。
不同反应条件对 产率的影响
产率的影响
(5)利用离子色谱法可以检测过滤3所得滤液中硫元素的含量,将样品通过检测液,进行色谱分析,得到如图所示结果,出现检测峰1的原因可能是___________ 。

(6)滤渣1通过下图所示操作可逐一分离硅、铝、铁三种元素,试剂①是___________ (填化学式),调节 的范围是
的范围是___________ 。


已知:①
②室温下,溶液
③相关金属离子形成氢氧化物沉淀的
| 金属离子 | |||
| 开始沉淀的 | 1.5 | 6.3 | 3.2 |
| 沉淀完全的 | 3.2 | 8.3 | 5.0 |
(1)产生的气体A是
a.粉碎矿石 b.适当升高“热溶浸”温度
c.适当缩短“热溶浸”时间 d.加快搅拌速度
(2)已知硼酸在水中的电离方程式为
(3)补充完整反应釜中发生主要反应的化学方程式:①
(4)根据下表,选择反应釜中的最佳反应条件:温度为
不同反应条件对
| 反应温度/℃ | ||
| 硫酸质量分数 | 硫酸质量分数 | |
| 60 | 9.5 | 54 |
| 70 | 11 | 62.5 |
| 80 | 37.4 | 78.8 |
| 90 | 47.7 | 82 |
| 100 | 47.1 | 81.4 |
| 110 | 46.5 | 80.5 |
| 120 | 46 | 79 |
(5)利用离子色谱法可以检测过滤3所得滤液中硫元素的含量,将样品通过检测液,进行色谱分析,得到如图所示结果,出现检测峰1的原因可能是

(6)滤渣1通过下图所示操作可逐一分离硅、铝、铁三种元素,试剂①是

废旧镍电池中含有的大量金属元素可重新回收利用,其中芯废料中主要含有镍元素,还含有钴、铝、铁、铬。利用废镍电池资源化生产醋酸钴晶体的工艺流程如下,请回答下列问题:
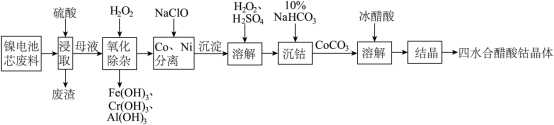
(1) 的价电子排布式为
的价电子排布式为______ 。
(2)为了加快“浸取”速率,可以采取的操作有______ (至少答两条)。
(3)下列说法正确的是______(填标号)。
(4)向氧化除杂后的滤液中加入次氯酸钠溶液,反应后溶液呈酸性, 转化为
转化为 而
而 不发生变化,从而实现钴镍分离,写出该过程中发生反应的离子方程式:
不发生变化,从而实现钴镍分离,写出该过程中发生反应的离子方程式:______ 。
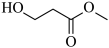
(5)可用CO气体与碱性醋酸钴溶液在一定条件下反应,先在反应釜中制备催化剂四羰基钴钠 ,一定条件下,反应原理:
,一定条件下,反应原理: 。然后在原釜中继续合成3-羟基丙酸甲酯(MHP):
。然后在原釜中继续合成3-羟基丙酸甲酯(MHP): +CO+CH3OH
+CO+CH3OH
 。在不同条件下,探究四羰基钴钠催化环氧乙烷(EO)羰基化合成3-羟基丙酸甲酯(MHP)的性能,结果如图所示。
。在不同条件下,探究四羰基钴钠催化环氧乙烷(EO)羰基化合成3-羟基丙酸甲酯(MHP)的性能,结果如图所示。

由图可知,四羰基钴钠催化环氧乙烷(EO)羰基化合成MHP时,当温度高于80℃时,MHP的收率迅速降低的主要原因可能为______ 。压强大于3.0 MPa时,MHP的收率迅速降低的主要原因可能为______ 。
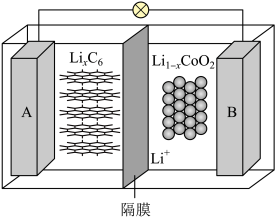
(6) 与纯碱反应可以制备重要的电极材料钴酸锂(
与纯碱反应可以制备重要的电极材料钴酸锂( )。一种充电电池的装置如下图所示,充放电过程中,存在
)。一种充电电池的装置如下图所示,充放电过程中,存在 与
与 之间的转化,放电过程中
之间的转化,放电过程中 从A电极向B电极迁移,写出该电池放电时正极反应:
从A电极向B电极迁移,写出该电池放电时正极反应:______ 。

(1)
(2)为了加快“浸取”速率,可以采取的操作有
(3)下列说法正确的是______(填标号)。
| A.浸取时用浓硫酸效果更好 |
| B.过氧化氢在氧化除杂和溶解中的作用不同 |
| C.结晶步骤:应加热至大量晶体析出时,停止加热 |
| D.“沉钴”步骤:选择 |
(5)可用CO气体与碱性醋酸钴溶液在一定条件下反应,先在反应釜中制备催化剂四羰基钴钠
 +CO+CH3OH
+CO+CH3OH 。在不同条件下,探究四羰基钴钠催化环氧乙烷(EO)羰基化合成3-羟基丙酸甲酯(MHP)的性能,结果如图所示。
。在不同条件下,探究四羰基钴钠催化环氧乙烷(EO)羰基化合成3-羟基丙酸甲酯(MHP)的性能,结果如图所示。
由图可知,四羰基钴钠催化环氧乙烷(EO)羰基化合成MHP时,当温度高于80℃时,MHP的收率迅速降低的主要原因可能为
(6)

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
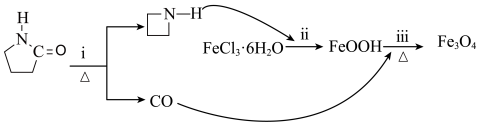
 的作用是
的作用是

