解答题-结构与性质 较难0.4 引用1 组卷186
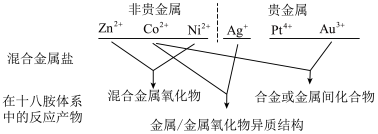
我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如 等)。
等)。
已知元素的电负性数据:
回答下列问题:
(1)十八胺含有氮元素,它在元素周期表中的位置为_______ 。三种含氮离子 、
、 的键角由大到小的顺序是
的键角由大到小的顺序是_______ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是_______ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物 而非
而非 的原因是
的原因是_______ 。
(4)推测 盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为_______ 。
(5)一种含钴的离子结构如图所示。
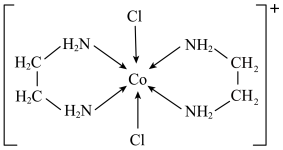
 的价电子排布式是
的价电子排布式是_______ 。已知磁矩 (n表示末成对电子数),则
(n表示末成对电子数),则 的磁矩
的磁矩
_______ 。

已知元素的电负性数据:
| 元素 | |||||||
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺含有氮元素,它在元素周期表中的位置为
(2)
(3)以
(4)推测
(5)一种含钴的离子结构如图所示。

22-23高二上·山东菏泽·开学考试
类题推荐
构成物质的微粒种类及相互间的作用力是影响物质性质的主要因素。
(1)已知:H与O可以形成H2O和H2O2两种化合物。
①H2O内O-H(a)、水分子间的范德华力(b)和氢键(c),从强到弱的顺序为______ 。(用a、b、c表示)。H+可与H2O形成H3O+,H3O+中H-O-H的键角比H2O中的大,原因是______ 。
②H2O2是常用的氧化剂,分子结构如图所示。
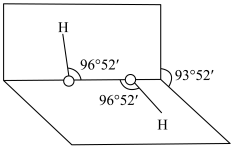
i.H2O2的电子式是______ 。
ii.下列关于H2O2的说法中正确的是______ (填序号)。。
a.分子中含有极性键和非极性键
b.氧原子的轨道发生了sp3杂化
c.分子是非极性分子
iii.H2O2易溶于水,难溶于CC14,主要原因是______ 。
(2)已知:在一定条件下,十八胺具有一定的还原性,不同的金属盐与十八胺体系反应可以得到不同的产物,产物的差异与金属离子获得电子的能力有关。
表1部分金属元素的电负性
表2单一金属盐与十八胺体系反应得到的产物
①请结合上述信息,分析不同的金属盐与十八胺体系反应得到不同类型产物的原因:Zn、Co、Ni元素电负性相对较小,获得电子的能力相对较弱,在反应中未发生元素化合价的变化,得到金属氧化物:______ 。
②Co2+和Pd2+盐混合后再与十八胺体系反应得到金属间化合物CoPd2.该化合物中Co原子与Pd原子间的作用力是______ (填“离子键”或“共价键”),依据表1信息写出判断理由______ 。
③Pt4+盐与十八胺体系的反应与上述反应类似。请推测单一Pt4+盐与十八胺体系的反应的产物是______ 。
(1)已知:H与O可以形成H2O和H2O2两种化合物。
①H2O内O-H(a)、水分子间的范德华力(b)和氢键(c),从强到弱的顺序为
②H2O2是常用的氧化剂,分子结构如图所示。

i.H2O2的电子式是
ii.下列关于H2O2的说法中正确的是
a.分子中含有极性键和非极性键
b.氧原子的轨道发生了sp3杂化
c.分子是非极性分子
iii.H2O2易溶于水,难溶于CC14,主要原因是
(2)已知:在一定条件下,十八胺具有一定的还原性,不同的金属盐与十八胺体系反应可以得到不同的产物,产物的差异与金属离子获得电子的能力有关。
表1部分金属元素的电负性
| 金属元素 | Zn | Co | Ni | Ag | Pd | Pt |
| 电负性 | 1.65 | 1.88 | 1.91 | 1.93 | 2.2 | 2.2 |
| 金属盐中的金属离子 | Zn2+ | Co2+ | Ni2+ | Ag+ | Pd2+ |
| 反应产物 | ZnO | CoO | NiO | Ag | Pd |
②Co2+和Pd2+盐混合后再与十八胺体系反应得到金属间化合物CoPd2.该化合物中Co原子与Pd原子间的作用力是
③Pt4+盐与十八胺体系的反应与上述反应类似。请推测单一Pt4+盐与十八胺体系的反应的产物是
2020年12月17日嫦娥五号返回器带回月球土壤样品。研究发现,月球土壤样品中存在铁、金、银、铅、锌、铜等矿物颗粒。请回答下列问题:
(1)基态Fe原子的价电子排布式为______ ,其核外填充有电子的原子轨道数目为______ ,基态Fe2+与Fe3+离子中未成对电子数之比为______ 。邻二氮菲(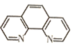 )中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因
)中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因______ 。
(2)Zn元素在元素周期表中的位置为______ ,它的基态原子的M电子层中电子占据的最高能级是______ ,该能级有______ 对成对电子。
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
已知元素的电负性数据:
据此推测单一的金属(Au3+)盐在十八胺体系中反应的产物为______ (写化学式)。
(4)分析Cu、Zn的核外电子排布,推测Cu的第二电离能I2______ Zn的第二电离能I2(填写“大于”、“小于”或“等于”)。
(1)基态Fe原子的价电子排布式为
 )中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因
)中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因(2)Zn元素在元素周期表中的位置为
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
| 单一金属盐 | Zn2+ | Ag+ |
| 在十八胺体系中的产物 | ZnO | Ag |
已知元素的电负性数据:
| 元素 | Zn | Ag | Au |
| 电负性(鲍林标度) | 1.6 | 1.9 | 2.4 |
据此推测单一的金属(Au3+)盐在十八胺体系中反应的产物为
(4)分析Cu、Zn的核外电子排布,推测Cu的第二电离能I2
2020年12月17日嫦娥五号返回器带回月球土壤样品。研究发现,月球土壤样品中存在铁、金、银、铅、锌、铜等矿物颗粒。请回答下列问题:
(1)基态Fe原子的价电子排布式为___________ ,其核外填充有电子的原子轨道数目为___________ ,基态Fe2+与Fe3+中未成对电子数之比为___________ 。邻二氮菲(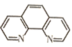 )中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响
)中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响___________ 。
(2)Zn元素在元素周期表中的位置为___________ ,它的基态原子的M电子层中电子占据的最高能级是___________ ,该能级有___________ 对成对电子。
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
已知元素的电负性数据:
据此推测单一的金属(Au3+)盐在十八胺体系中反应的产物为___________ (写化学式)。
(1)基态Fe原子的价电子排布式为
 )中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响
)中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响(2)Zn元素在元素周期表中的位置为
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
| 单一金属盐 | Zn2+ | Ag+ |
| 在十八胺体系中的产物 | ZnO | Ag |
已知元素的电负性数据:
| 元素 | Zn | Ag | Au |
| 电负性(鲍林标度) | 1.6 | 1.9 | 2.4 |
据此推测单一的金属(Au3+)盐在十八胺体系中反应的产物为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


