解答题-工业流程题 较易0.85 引用1 组卷186
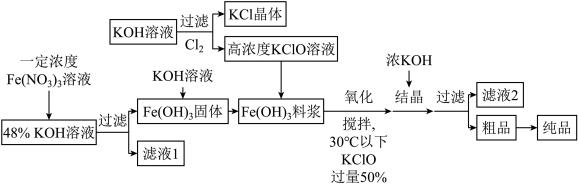
高铁酸钾( )是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物
)是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物 可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为
可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为 )制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:
)制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:

(1) 中Fe呈
中Fe呈___ 价;列举 常见的一种用途:
常见的一种用途:________ 。
(2)该小组同学准备利用KMnO4与浓盐酸制取Cl2,请写出该反应的离子方程式:__________ ;用电子式表示Cl2的形成过程:_________________ 。
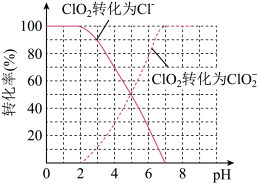
(3)已知:低温时,Cl2与NaOH生成NaClO与NaCl;高温时,Cl2与NaOH反应生成NaClO3与NaCl。若测得Cl2与KOH反应后的溶液中c(K+)=8 mol∙L−1,且 =1:5,则溶液中c(ClO-)=
=1:5,则溶液中c(ClO-)=______ mol∙L−1。(设KOH与Cl2恰好完全反应)
(4)该流程中进行了多次过滤操作,请写出过滤时需要用到的玻璃仪器:___________ 。
(5) 在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为
在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为________ mol。

(1)
(2)该小组同学准备利用KMnO4与浓盐酸制取Cl2,请写出该反应的离子方程式:
(3)已知:低温时,Cl2与NaOH生成NaClO与NaCl;高温时,Cl2与NaOH反应生成NaClO3与NaCl。若测得Cl2与KOH反应后的溶液中c(K+)=8 mol∙L−1,且
(4)该流程中进行了多次过滤操作,请写出过滤时需要用到的玻璃仪器:
(5)
22-23高一上·辽宁辽阳·期末
类题推荐
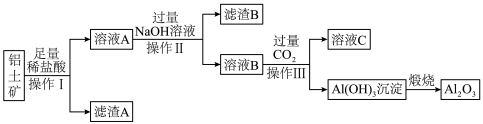
I.铝土矿是工业上制备金属铝的主要原料,其主要成分是 ,同时还含有
,同时还含有 、
、 。工业上可使用碱浸法提取铝土矿中的
。工业上可使用碱浸法提取铝土矿中的 ,其工业流程如图所示。根据图示信息,请回答下列问题:
,其工业流程如图所示。根据图示信息,请回答下列问题:_______ ,滤渣B的主要成分是_______ (填化学式)。
(2)实验室中进行煅烧时最适合用来盛放 固体的实验仪器名称是
固体的实验仪器名称是_______ 。
(3)用 与C、
与C、 在高温条件下反应可制取
在高温条件下反应可制取 ,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是
,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是_______ 。
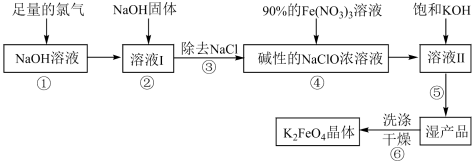
Ⅱ.高铁酸钾( )具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程: 的部分性质如下:
的部分性质如下:
(4)写出①中发生的离子方程式:_______ 。
(5)②中加入NaOH固体的目的是_______ (填字母序号)
A.加入NaOH固体做氧化剂
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成
(6)完成④中反应的离子方程式:_______ 。
(7)⑥中洗涤时,洗涤剂最好选用_______(填字母序号)。
(8)现取洗涤并干燥后 样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
(2)实验室中进行煅烧时最适合用来盛放
(3)用
Ⅱ.高铁酸钾(
溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中Fe变为+3价并放出 |
(4)写出①中发生的离子方程式:
(5)②中加入NaOH固体的目的是
A.加入NaOH固体做氧化剂
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成
(6)完成④中反应的离子方程式:
(7)⑥中洗涤时,洗涤剂最好选用_______(填字母序号)。
| A. | B.KOH溶液 | C.异丙醇 | D. |
(8)现取洗涤并干燥后
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网