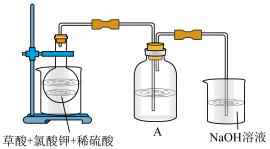
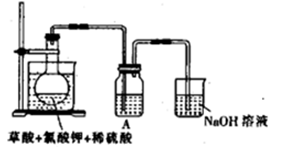
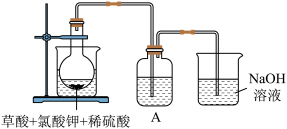
解答题-实验探究题 适中0.65 引用1 组卷487
二氧化氯( )是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法
)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法 发生器进行消毒的水中含有中等毒性的
发生器进行消毒的水中含有中等毒性的 ,进一步研究表明
,进一步研究表明 是由于
是由于 制备过程中未完全反应的
制备过程中未完全反应的 原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。
实验原理: 溶液(质量分数
溶液(质量分数 )与盐酸溶液(
)与盐酸溶液( 质量分数
质量分数 )经计量泵按
)经计量泵按 比例进入发生器连续进行反应,并在水射器的抽吸作用下,将
比例进入发生器连续进行反应,并在水射器的抽吸作用下,将 等产物和含有
等产物和含有 与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
与盐酸的反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
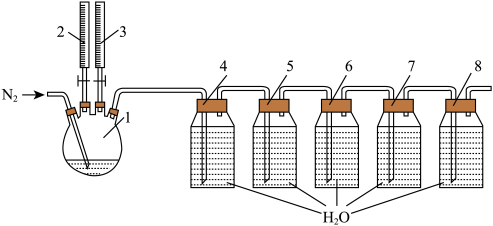
实验步骤:
i.将 溶液与盐酸溶液按
溶液与盐酸溶液按 比例加入烧瓶1中,产生黄绿色气体后通入高纯
比例加入烧瓶1中,产生黄绿色气体后通入高纯 ;
;
ⅱ.反应90分钟,将5个广口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
iii.分别在反应温度 重复上述过程;
重复上述过程;
iv.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:_______ ;为确保实验准确性,控制反应温度,发生装置选择的加热方式:_______ 。
(2)烧瓶1中反应的化学方程式:_______ 。
(3)若已知所用盐酸的密度是 。则盐酸的浓度是:
。则盐酸的浓度是:_______ 。
(4)通入高纯 的作用:
的作用:_______ 。
(5) 转化率及
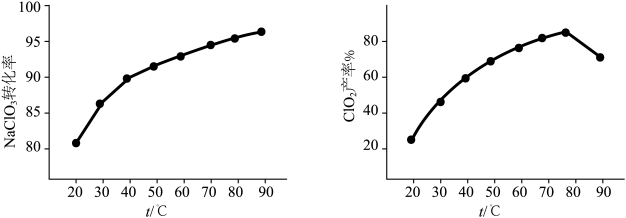
转化率及 产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量
产率随温度的变化如下图,据图可知,随反应温度的提高,氯酸盐残留量_______ (填“升高”或“降低”):改变反应时间,重复实验, 产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析
产率随温度变化趋势均如下图所示,不考虑有副反应发生,试从装置角度分析 时
时 产率降低的可能原因
产率降低的可能原因_______ 。
(6)二氧化氯可氧化 等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是
等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是_______ 。
a.含二氧化氯漱口水去除口腔异味 b.酒精消毒 c.明矾净水
实验原理:

实验步骤:
i.将
ⅱ.反应90分钟,将5个广口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
iii.分别在反应温度
iv.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:
(2)烧瓶1中反应的化学方程式:
(3)若已知所用盐酸的密度是
(4)通入高纯
(5)

(6)二氧化氯可氧化
a.含二氧化氯漱口水去除口腔异味 b.酒精消毒 c.明矾净水
22-23高三上·辽宁沈阳·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网