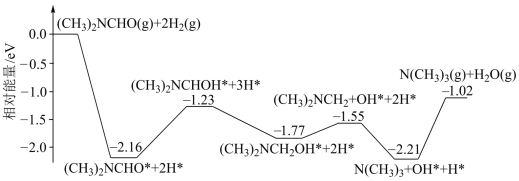
填空题 较易0.85 引用1 组卷106
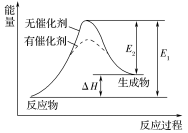
根据如图所示的反应,回答下列问题:
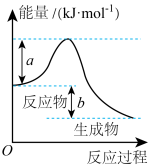
(1)该反应是放热反应,还是吸热反应?_______ 。
(2)反应的
_______ 。
(3)反应的活化能为_______ 。
(4)试在上图中用虚线表示在反应中使用催化剂后活化能的变化情况_______ 。

(1)该反应是放热反应,还是吸热反应?
(2)反应的
(3)反应的活化能为
(4)试在上图中用虚线表示在反应中使用催化剂后活化能的变化情况
2023高三·全国·专题练习
类题推荐
活化能
理论解释
(1)活化分子、活化能、有效碰撞
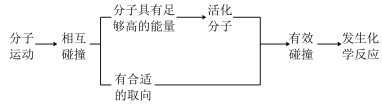
i.活化分子:能够发生_______ 的分子。
ii.活化能:如图
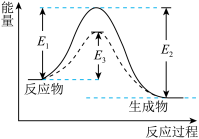
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2.(注:E2为逆反应的活化能)
iii.有效碰撞:活化分子之间能够引发_______ 的碰撞。
iii.用碰撞理论理解化学反应的过程
(2)活化分子、有效碰撞与反应速率的关系
有效碰撞的频率越高,则反应速率_______ 。
(3)正确理解活化能与反应热的关系
①催化剂能降低反应所需活化能,但不影响_______ 的大小
②在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即:E1=E2+ΔH
(4)影响化学反应速率的内因——活化能
①相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率_______ ,活化能大的反应速率_______
②活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最小能量,即活化分子比普通分子所多出的那部分能量
③化学反应速率与分子间的有效碰撞频率有关,所有能够改变内能、运动速率,以及碰撞几率的方法,都可以用来改变、控制反应的速率,即:活化分子百分数和单位体积活化分子数增大时,化学反应速率也就增大
(5)过渡态理论对催化剂影响化学反应速率的解释:使用催化剂→改变了反应的路径(如图),反应的活化能_______ →活化分子的百分数_______ →反应速率_______ 。
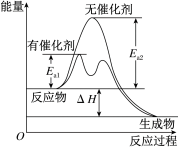
理论解释
(1)活化分子、活化能、有效碰撞
i.活化分子:能够发生
ii.活化能:如图

图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2.(注:E2为逆反应的活化能)
iii.有效碰撞:活化分子之间能够引发
iii.用碰撞理论理解化学反应的过程

(2)活化分子、有效碰撞与反应速率的关系
有效碰撞的频率越高,则反应速率
(3)正确理解活化能与反应热的关系

①催化剂能降低反应所需活化能,但不影响
②在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即:E1=E2+ΔH
(4)影响化学反应速率的内因——活化能
①相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率
②活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最小能量,即活化分子比普通分子所多出的那部分能量
③化学反应速率与分子间的有效碰撞频率有关,所有能够改变内能、运动速率,以及碰撞几率的方法,都可以用来改变、控制反应的速率,即:活化分子百分数和单位体积活化分子数增大时,化学反应速率也就增大
| 外界因素 | 活化能 | 分子总数 | 活化分子总数 | 活化分子百分数 | 单位体积活化分子数 | 有效碰撞次数 | 反应速率 |
| 增大反应 物的浓度 | 不变 | 增多 | 增多 | 不变 | 增多 | 增多 | 加快 |
| 增大反应物的压强 | 不变 | 不变 | 不变 | 不变 | 增多 | 增多 | 加快 |
| 升高反应 物的温度 | 不变 | 不变 | 增多 | 增多 | 增多 | 增多 | 加快 |
| 使用催化剂 | 降低 | 不变 | 增多 | 增多 | 增多 | 增多 | 加快 |
(5)过渡态理论对催化剂影响化学反应速率的解释:使用催化剂→改变了反应的路径(如图),反应的活化能

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网