解答题-实验探究题 适中0.65 引用1 组卷286
铁及其化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)人体对 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起_______ 剂。
(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为_______ 。
(3)实验室中储存 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的_______ 。
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量 )制备
)制备 。操作过程如下:
。操作过程如下:
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。
①步骤ii中加入过量氧化剂 的目的是
的目的是_______ 。离子方程式为_______ 。
②设计实验验证操作i所得溶液中不含 ,简述实验操作及现象:
,简述实验操作及现象:_______ 。
③该小组同学认为即使操作i所得溶液中不含 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为_______ 。
(5)羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
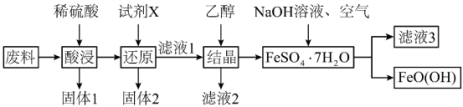
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
①“固体1”的主要成分是_______ 。
②“酸浸”时CuO与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铜粉 C.铁粉 D.钠块
(1)人体对
(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为
(3)实验室中储存
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂
①步骤ii中加入过量氧化剂
②设计实验验证操作i所得溶液中不含
③该小组同学认为即使操作i所得溶液中不含
(5)羟基氧化铁

已知:
①“固体1”的主要成分是
②“酸浸”时CuO与硫酸发生反应的离子方程式为
A.双氧水 B.铜粉 C.铁粉 D.钠块
22-23高一上·辽宁铁岭·期末
类题推荐
I.金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物相关知识回答下列问题:
(1)某溶液中有Mg2+、Fe2+、A13+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________。
(2)高铁酸钠(Na2FeO4)是一种新型水处理剂。某兴趣小组欲利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取高铁酸钠并回收金属Cu,其工艺流程如下:
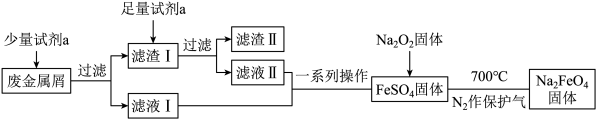
①试剂a为___________ (填化学式,下同),滤渣Ⅱ的主要成分为___________ 。
②在过滤操作中要使用玻璃棒,其作用是___________ 。
③检验滤液I中是否存在Fe3+的试剂是___________ 。
Ⅱ.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。
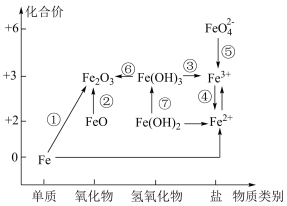
(3)下列说法正确的是___________。
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(5)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为___________ 。
(1)某溶液中有Mg2+、Fe2+、A13+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________。
| A.Mg2+ | B.Fe2+ | C.A13+ | D.Cu2+ |
(2)高铁酸钠(Na2FeO4)是一种新型水处理剂。某兴趣小组欲利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取高铁酸钠并回收金属Cu,其工艺流程如下:

①试剂a为
②在过滤操作中要使用玻璃棒,其作用是
③检验滤液I中是否存在Fe3+的试剂是
Ⅱ.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。

(3)下列说法正确的是___________。
| A.Fe2O3是碱性氧化物 |
| B.铁与高温水蒸气的反应可实现上述转化① |
| C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化② |
| D.硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果 |
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(5)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为
在人类社会的发展进程中,金属起着重要的作用。请回答下列问题:
(1)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,错误的是_______(填标号)。
(2)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是_______ (填离子符号)。
(3)铁及其化合物在生产生活中具有广泛应用。一定条件下,铁及其化合物之间发生相互转化。NaFeO2可完全溶于水且与水反应生成两种碱,写出发生反应的离子方程式:_______ 。
(4)某溶液中有Mg2+、Fe2+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______ (填离子符号)。
(5)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:
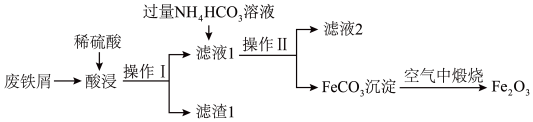
①完成“操作Ⅰ”所需要的玻璃仪器除烧杯外,还需要的是_______ 。
②加入稍过量NH4HCO3溶液时,不仅有沉淀生成,还有无色无味的气体生成,请写出生成FeCO3沉淀的离子方程式:_______ 。
③FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为_______ 。
(1)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,错误的是_______(填标号)。
| A.青铜、不锈钢、硬铝都是合金 |
| B.铜表面易形成致密的氧化膜 |
| C.铜与O2反应可生成黑色的CuO |
| D. |
(3)铁及其化合物在生产生活中具有广泛应用。一定条件下,铁及其化合物之间发生相互转化。NaFeO2可完全溶于水且与水反应生成两种碱,写出发生反应的离子方程式:
(4)某溶液中有Mg2+、Fe2+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
(5)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:

①完成“操作Ⅰ”所需要的玻璃仪器除烧杯外,还需要的是
②加入稍过量NH4HCO3溶液时,不仅有沉淀生成,还有无色无味的气体生成,请写出生成FeCO3沉淀的离子方程式:
③FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为
某种常见补铁药物的主要成分为琥珀酸亚铁,该药品难溶于水但能溶于常见稀酸。某学习小组同学设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。已知K3[Fe(CN)6]与Fe2+会产生蓝色沉淀。回答下列问题:
(1)甲同学为了检验药品中Fe2+的存在。将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。滤液加入K3[Fe(CN)6]溶液或KSCN溶液中均未出现明显现象,其主要原因为_______ 。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本药品10片,碾碎后加入一定浓度的稀硫酸,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液后,再加入过量 NaOH溶液,产生沉淀,将沉淀过滤出来后洗涤、干燥,灼烧至固体质量恒定,得0.64g固体。
①步骤二中,量取20.00mL溶液应使用的仪器为_______ (填“酸式滴定管”、“碱式滴定管”或“25mL量筒”)。
②步骤三中,加入H2O2溶液时发生反应的离子方程式为_______ ,灼烧后所得固体的颜色为_______ 。
③若将步骤三中的H2O2溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______ 。
④由实验数据计算,每片药片中含_______ mg Fe2+。
(3)FeSO4也可用作补铁剂,使用时建议与维生素C同服,甲同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?回答并说明理由:_______ 。
(1)甲同学为了检验药品中Fe2+的存在。将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。滤液加入K3[Fe(CN)6]溶液或KSCN溶液中均未出现明显现象,其主要原因为
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本药品10片,碾碎后加入一定浓度的稀硫酸,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液后,再加入过量 NaOH溶液,产生沉淀,将沉淀过滤出来后洗涤、干燥,灼烧至固体质量恒定,得0.64g固体。
①步骤二中,量取20.00mL溶液应使用的仪器为
②步骤三中,加入H2O2溶液时发生反应的离子方程式为
③若将步骤三中的H2O2溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是
④由实验数据计算,每片药片中含
(3)FeSO4也可用作补铁剂,使用时建议与维生素C同服,甲同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


