解答题-原理综合题 适中0.65 引用1 组卷55
按要求完成下列方程式的书写:
(1)在实验室配制 溶液时,常滴加几滴
溶液时,常滴加几滴 溶液,试用离子方程式说明原因:
溶液,试用离子方程式说明原因:____ 。
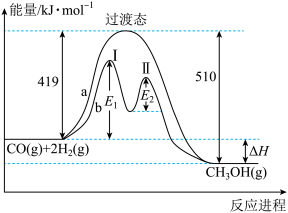
(2)汽车发动机工作时会引发 和
和 反应,其能量变化示意图如下(常温常压下测定):
反应,其能量变化示意图如下(常温常压下测定):
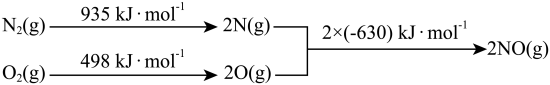
写出该反应的热化学方程式:_______________________ 。
(3)已知:常温下, 的电离常数
的电离常数 ;
; 的电离常数
的电离常数 ,
, 。向
。向 溶液中通入少量
溶液中通入少量 气体,则发生反应的离子方程式为
气体,则发生反应的离子方程式为_____________ 。
(4)用电解法处理含铬废水(主要成分 )时,以铁板作阴、阳极,处理过程中在电解质溶液中发生反应:
)时,以铁板作阴、阳极,处理过程中在电解质溶液中发生反应: ,最后
,最后 以
以 形式除去,则阳极的电极反应式为
形式除去,则阳极的电极反应式为_______________________ 。
(5)我国学者结合实验与计算机模拟结果,研究了丙烷在六方氮化硼催化剂表面氧化脱氢制丙烯的反应历程,部分历程如图所示,其中吸附在催化剂表面的物种用 标注。
标注。
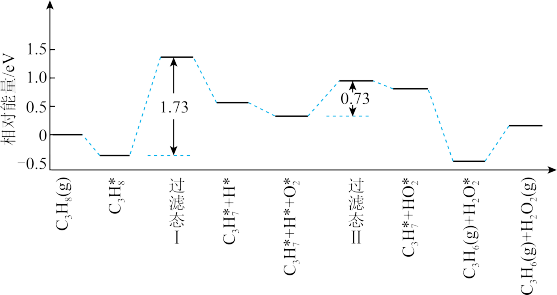
该历程中决速步骤对应的化学方程式为_______________________ 。
(1)在实验室配制
(2)汽车发动机工作时会引发

写出该反应的热化学方程式:
(3)已知:常温下,
(4)用电解法处理含铬废水(主要成分
(5)我国学者结合实验与计算机模拟结果,研究了丙烷在六方氮化硼催化剂表面氧化脱氢制丙烯的反应历程,部分历程如图所示,其中吸附在催化剂表面的物种用

该历程中决速步骤对应的化学方程式为
22-23高二上·河南许昌·期末
知识点:根据△H=反应物的键能之和-生成物的键能之和进行计算催化剂对化学反应速率的影响电解池电极反应式及化学方程式的书写与判断弱电解质的电离平衡常数 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网