解答题-原理综合题 适中0.65 引用1 组卷188
工业上利用天然气制备 ,还可得到
,还可得到 、
、 等化工产品。一定条件下,有关反应如下:
等化工产品。一定条件下,有关反应如下:
反应1:

反应2:

回答下列问题:
(1)相同条件下,反应
 ,
,
_______  。
。
(2)实验测得反应1的速率方程: ,
, (
( 、
、 分别为正、逆反应速率常数)。
分别为正、逆反应速率常数)。
①结合速率的影响因素,推测速率常数k的影响因素有_______ (填标号)。
A.温度 B.浓度 C.催化剂 D.固体表面性质
②T℃下反应达到平衡时 ,该温度下平衡常数
,该温度下平衡常数
_______ 。
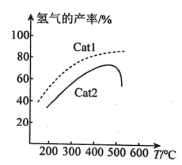
(3)向恒温恒容密闭容器中充入适量 ,同时发生上述反应1和反应2,在不同催化剂
,同时发生上述反应1和反应2,在不同催化剂 、
、 作用下,测得单位时间内
作用下,测得单位时间内 的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是
的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是_______ (填“ ”或“
”或“ ”)。在
”)。在 作用下,温度高于500℃时,
作用下,温度高于500℃时, 的产率降低的可能原因是
的产率降低的可能原因是_______ 。
(4)一定温度下,总压强恒定为 时,向密闭容器中充入
时,向密闭容器中充入 和
和 的混合气体(
的混合气体( 不参与反应),同时发生反应1和反应2,测得
不参与反应),同时发生反应1和反应2,测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如下图所示。
的物质的量分数的关系如下图所示。
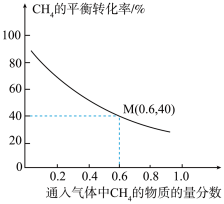
①随着通入气体中 的物质的量分数增大,
的物质的量分数增大, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是_______ 。
②已知M点对应的乙炔的选择性为75%(乙炔的选择性 )。该温度下,反应2的平衡常数
)。该温度下,反应2的平衡常数
_______  (结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为
(结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为 ,
, 。)
。)
反应1:
反应2:
回答下列问题:
(1)相同条件下,反应
(2)实验测得反应1的速率方程:
①结合速率的影响因素,推测速率常数k的影响因素有
A.温度 B.浓度 C.催化剂 D.固体表面性质
②T℃下反应达到平衡时
(3)向恒温恒容密闭容器中充入适量

(4)一定温度下,总压强恒定为

①随着通入气体中
②已知M点对应的乙炔的选择性为75%(乙炔的选择性
22-23高二上·福建漳州·期末
类题推荐
2022年北京冬奥会主火炬首次采用以氢气为燃料的微火形式,体现了绿色奥运理念。工业上,利用天然气制备氢气,还可得到乙烯、乙炔等化工产品,有关反应原理如下:
反应1:

反应2:

请回答下列问题:
(1)已知几种物质的燃烧热数据如下:
①能表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
②上述反应中,
_______  。
。
(2)向恒温恒容密闭容器中充入适量 ,发生上述反应1和反应2。下列情况不能说明上述反应达到平衡状态的是_______(填标号)。
,发生上述反应1和反应2。下列情况不能说明上述反应达到平衡状态的是_______(填标号)。
(3)实验测得 的速率方程:
的速率方程: ,
, (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。T1℃下反应达到平衡时
分别为正、逆反应速率常数,只与温度、催化剂有关)。T1℃下反应达到平衡时 ,T2℃下反应达到平衡时
,T2℃下反应达到平衡时 。由此推知,T1
。由此推知,T1_______ (填“>”、“<”或“=”)T2。
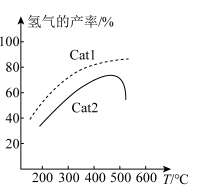
(4)在密闭容器中充入 ,发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内
,发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内 的产率与温度的关系如图1。在其他条件相同时,催化效率较高的
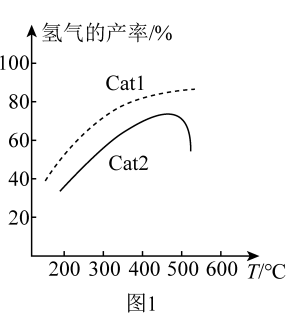
的产率与温度的关系如图1。在其他条件相同时,催化效率较高的_______ 是(填“Cat1”或“Cat2“”)。在Cat2作用下,温度高于500℃时, 的产率降低的可能原因是
的产率降低的可能原因是_______ 。
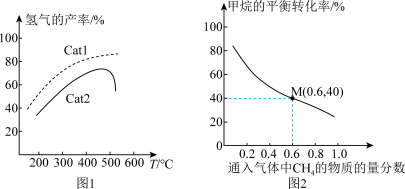
(5)一定温度下,总压强恒定为121kPa时,向密闭容器中充入由 和
和 组成的混合气体(
组成的混合气体( 不参与反应),同时发生反应1和反应2,测得
不参与反应),同时发生反应1和反应2,测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图2。
的物质的量分数的关系如图2。
①图2中,随着通入气体中 的物质的量分数增大,甲烷的平衡转化率降低的主要原因是
的物质的量分数增大,甲烷的平衡转化率降低的主要原因是_______ 。
②已知M点对应的乙炔的选择性为75%[提示:乙炔的选择性 ]。该温度下,反应2的平衡常数
]。该温度下,反应2的平衡常数
_______ (结果保留2位有效数字)kPa。
提示:用平衡时气体分压计算的平衡常数为 ,气体分压等于气体总压×气体的物质的量分数。
,气体分压等于气体总压×气体的物质的量分数。
反应1:
反应2:
请回答下列问题:
(1)已知几种物质的燃烧热数据如下:
| 物质 | ||||
| 燃烧热 | -890.3 | -1299.5 | -1411.0 | -285.8 |
②上述反应中,
(2)向恒温恒容密闭容器中充入适量
| A.气体总压强不随时间变化 | B.气体密度不随时间变化 |
| C.气体平均摩尔质量不随时间变化 | D. |
(4)在密闭容器中充入

(5)一定温度下,总压强恒定为121kPa时,向密闭容器中充入由
①图2中,随着通入气体中
②已知M点对应的乙炔的选择性为75%[提示:乙炔的选择性
提示:用平衡时气体分压计算的平衡常数为
2022年北京冬奥会主火炬首次采用以氢气为燃料的微火形式,体现了绿色奥运理念。工业上,利用天然气制备氢气,还可得到乙烯、乙炔等化工产品,有关反应原理如下:
反应l:2CH4(g) C2H2(g)+3H2(g) △H1
C2H2(g)+3H2(g) △H1
反应2:2CH4(g) C2H4(g)+2H2(g) △H2
C2H4(g)+2H2(g) △H2
请回答下列问题:
(1)已知几种物质的燃烧热数据如下:
能表示C2H2(g)燃烧热的热化学方程式为_______ 。
(2)向恒温恒容密闭容器中充入适量CH4,发生上述反应1和反应2。下列情况不能说明上述反应达到平衡状态的是_______(填标号)。
(3)实验测得2CH4(g) C2H2(g)+3H2(g)的速率方程:v正=k正c2(CH4),v逆=k逆·c(C2H2)·c3(H2)(k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。T1℃下反应达到平衡时k正=1.5k逆,T2℃下反应达到平衡时k正=3k逆。由此推知,T1
C2H2(g)+3H2(g)的速率方程:v正=k正c2(CH4),v逆=k逆·c(C2H2)·c3(H2)(k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。T1℃下反应达到平衡时k正=1.5k逆,T2℃下反应达到平衡时k正=3k逆。由此推知,T1_______ (填“>”、“<”或“=”)T2。
(4)在密闭容器中充入CH4,发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如图1。在其他条件相同时,催化效率较高的是_______ (填“Cat1”或“Cat2”)。在Cat2作用下,温度高于500°C时,H2的产率降低的可能原因是_______ 。
(5)一定温度下,总压强恒定为121kPa时,向密闭容器中充入由CH4和N2组成的混合气体(N2不参与反应),同时发生反应1和反应2,测得CH4的平衡转化率与通入气体中CH4的物质的量分数的关系如图2。
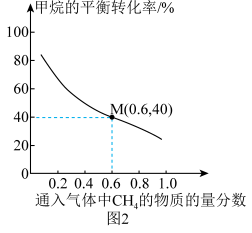
①图2中,随着通入气体中CH4的物质的量分数增大,甲烷的平衡转化率降低的主要原因是_______ 。
②已知M点对应的乙炔的选择性为75%[乙炔的选择性= ]。该温度下,生成的H2的分压为
]。该温度下,生成的H2的分压为_______ kPa。
反应l:2CH4(g)
反应2:2CH4(g)
请回答下列问题:
(1)已知几种物质的燃烧热数据如下:
| 物质 | CH4(g) | C2H2(g) | C2H4(g) | H2(g) |
| 燃烧热(ΔH/kJ·mol-1) | -890.3 | -1299.5 | -1411.0 | -285.8 |
(2)向恒温恒容密闭容器中充入适量CH4,发生上述反应1和反应2。下列情况不能说明上述反应达到平衡状态的是_______(填标号)。
| A.气体总压强不随时间变化 | B.气体密度不随时间变化 |
| C.气体平均摩尔质量不随时间变化 | D.H2体积分数不随时间变化 |
(4)在密闭容器中充入CH4,发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如图1。在其他条件相同时,催化效率较高的是

(5)一定温度下,总压强恒定为121kPa时,向密闭容器中充入由CH4和N2组成的混合气体(N2不参与反应),同时发生反应1和反应2,测得CH4的平衡转化率与通入气体中CH4的物质的量分数的关系如图2。

①图2中,随着通入气体中CH4的物质的量分数增大,甲烷的平衡转化率降低的主要原因是
②已知M点对应的乙炔的选择性为75%[乙炔的选择性=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 、
、 、
、 和
和 表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应Ⅲ,从吸附到解吸的过程中,能量状态最低的是
表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应Ⅲ,从吸附到解吸的过程中,能量状态最低的是