填空题 适中0.65 引用1 组卷456
I、下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:
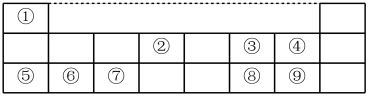
(1)元素⑧在周期表中的位置___________ ;
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式___________ 。
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为___________ 。
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式___________ 。
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫___________ mL(精确到小数点后1位)。
(6)配制过程中的正确操作顺序是:b、d___________ 、e(填“字母”)。
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是___________ 。
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶

(1)元素⑧在周期表中的位置
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫
(6)配制过程中的正确操作顺序是:b、d
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶
22-23高一上·重庆渝中·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网