单选题 适中0.65 引用1 组卷134
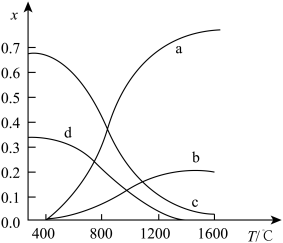
甲烷与硫化氢可通过重整反应制取氢气,反应为CH4+2H2S CS2+4H2.现将原料按n(CH4)∶n(H2S)=1∶2通入反应釜中,保持体系压强为0.1MPa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示,下列说法正确的是
CS2+4H2.现将原料按n(CH4)∶n(H2S)=1∶2通入反应釜中,保持体系压强为0.1MPa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示,下列说法正确的是


| A.该反应平衡常数的表达式为K= |
| B.图中表示H2S、H2物质的量分数变化的曲线分别是d、a |
| C.M点对应温度下,CH4的转化率约为33.3% |
| D.由图可知该反应为吸热反应,当 |
22-23高二上·湖北恩施·期末
类题推荐
我国高含硫天然气资源丰富,天然气脱硫和甲烷与硫化氢重整制氢具有重要的现实意义。
(1)天然气脱硫工艺涉及如下反应:
① 2H2S(g)+3O2(g)→2SO2(g)+2H2O(g)∆H =+ a kJ/mol
② 4H2S(g)+2SO2(g)→3S2(g)+4H2O(g)∆H= + b kJ/mol
③ 2H2S(g)+O2(g)→2S(g)+2H2O(g)∆H=+ c kJ/mol
若 2S(g)→S2(g)∆H=+Q/mol.。
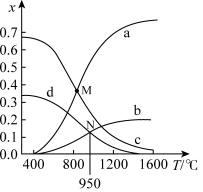
为了研究甲烷对H2S制氢的影响,原料初始组成n(CH4):n(H2S)=1:2。保持体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示:
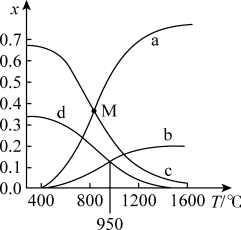
图中表示H2S、H2变化的曲线分别是:_______ 、_______
(2)反应达平衡的标志是_______(填标号)。
(3)由图可知该反应的∆H_______ 0(填”>”、”<”或“=”),判断的理由是_______ 。
(4)M点对应温度下,CH4的转化率为_______ 。
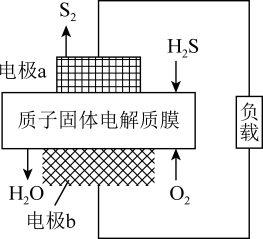
(5)H2S燃料电池的原理如图所示,则电池的正极是_______ 极(填a或b),负极的电极反应式为_______ 。
(1)天然气脱硫工艺涉及如下反应:
① 2H2S(g)+3O2(g)→2SO2(g)+2H2O(g)∆H =+ a kJ/mol
② 4H2S(g)+2SO2(g)→3S2(g)+4H2O(g)∆H= + b kJ/mol
③ 2H2S(g)+O2(g)→2S(g)+2H2O(g)∆H=+ c kJ/mol
若 2S(g)→S2(g)∆H=+Q/mol.。
为了研究甲烷对H2S制氢的影响,原料初始组成n(CH4):n(H2S)=1:2。保持体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示:

图中表示H2S、H2变化的曲线分别是:
(2)反应达平衡的标志是_______(填标号)。
| A.2v正(H2S)=4v逆(H2) |
| B.CH4的体积分数不再变化 |
| C.c(CH4)/c(H2S)不再变化 |
| D.混合气体的密度不再改变 |
(4)M点对应温度下,CH4的转化率为
(5)H2S燃料电池的原理如图所示,则电池的正极是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网