解答题-实验探究题 较易0.85 引用4 组卷581
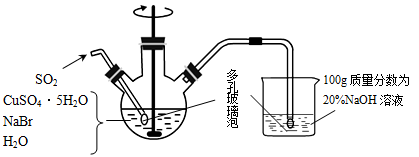
溴化亚铜(CuBr)是一种白色结晶状粉末,微溶于水,不溶于乙醇,在热水中或见光都会分解,常用作有机反应的催化剂。实验室制备CuBr的实验步骤和装置如下图。
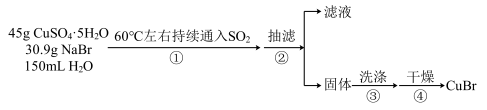
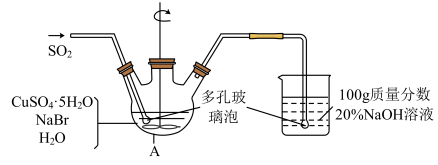
回答下列问题:
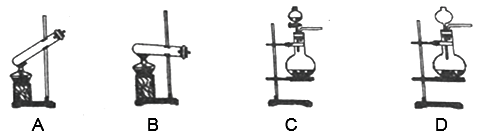
(1)仪器A的名称是_______ 。
(2)步骤①涉及的离子方程式为_______ ;可采取的加热方法是_______ 。
(3)步骤②操作中需要避光,其原因是_______ 。
(4)将产品在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。本实验产品的产率是_______ (保留小数点后1位)。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含有Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。完善下列步骤:①在烧杯中继续通入SO2至恰好反应完全;②向烧杯中加入_______ g 20% NaOH;③加入少量维生素C溶液作抗氧化剂;④通过蒸发浓缩、_______ 、过滤、用乙醇洗涤2~3次;⑤置于真空干燥箱中干燥。

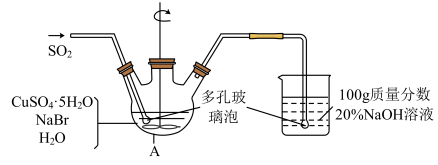
回答下列问题:
(1)仪器A的名称是
(2)步骤①涉及的离子方程式为
(3)步骤②操作中需要避光,其原因是
(4)将产品在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。本实验产品的产率是
(5)欲利用上述装置烧杯中的吸收液(经检测主要含有Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。完善下列步骤:①在烧杯中继续通入SO2至恰好反应完全;②向烧杯中加入
2023·湖北·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网