填空题 适中0.65 引用3 组卷96
常温下,几种常见的弱酸的电离平衡常数如下表所示:
(1)写出Na2CO3溶液中滴入少量CH3COOH溶液的离子方程式_______ 。
(2)用离子方程式表示Na2SO3溶液显碱性的原因_______ 。
(3)下列说法中不正确的是
(4)下列措施中,能减小CH3COONa溶液中CH3COO-水解程度的是_______
A.加入少量冰醋酸
B.升温
C.通入少量HCl
D.加入少量CH3COONa固体
E.加水稀释
| 酸 | CH3COOH | HClO | H2SO3 | H2CO3 |
| 电离平衡常数 | 1.75 × 10-5 | 4.0×10-8 | Ka1=1.4×10-2 Ka2=6.0×10-8 | Ka1=4.5×10-7 Ka2=-4.7×10-11 |
(2)用离子方程式表示Na2SO3溶液显碱性的原因
(3)下列说法中不正确的是
| A.已知漂白性:HClO>ClO-,漂白粉配制成溶液后放置在空气中,一段时间后漂白性会增强 |
| B.常温下,浓度均为0.1 mol/L的三种溶液: CH3COONa、NaClO、Na2CO3溶液中,碱性最强的是Na2CO3 |
| C.已知NaHSO3溶液显酸性,则其中c(H2SO3)>c( |
| D.常温下,浓度均为0.1 mol/L的HClO和H2SO3溶液混合,溶液酸性会增强 |
A.加入少量冰醋酸
B.升温
C.通入少量HCl
D.加入少量CH3COONa固体
E.加水稀释
22-23高二上·浙江杭州·期中
类题推荐
已知25℃时,三种酸的电离平衡常数如下:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为:___________
(2)将少量的CO2气体通入NaClO溶液中,写出反应的离子方程式:___________
(3)常温下,将0.1 mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是___________
(4)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,请填写空白。
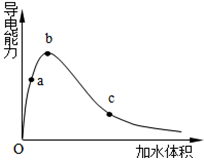
①a、b、c三点对应的溶液中c(H+)由小到大的顺序为___________
②a、b、c三点对应的溶液中CH3COOH的电离程度最大的是___________
③若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是___________ (填序号)
A.加入水 B.加入少量的NaOH溶液(体积变化忽略不计)
C.加入浓硫酸 D.加入碳酸钠固体
④a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液体积的大小关系为___________ 。
(5)工业上采取用氨水除去SO2,已知25 ℃,NH3• H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3 × 10-2,Ka2=6.2 × 10-8。若氨水的浓度为2.0 mol/ L,溶液中的c(OH-)约为___________ mol/ L;将SO2通入该氨水中,当c(OH-)降至2.0 × 10-6mol/ L时,溶液中的 =
=___________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
(2)将少量的CO2气体通入NaClO溶液中,写出反应的离子方程式:
(3)常温下,将0.1 mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是___________
| A.n(H+) | B. | C. | D. |

①a、b、c三点对应的溶液中c(H+)由小到大的顺序为
②a、b、c三点对应的溶液中CH3COOH的电离程度最大的是
③若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是
A.加入水 B.加入少量的NaOH溶液(体积变化忽略不计)
C.加入浓硫酸 D.加入碳酸钠固体
④a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液体积的大小关系为
(5)工业上采取用氨水除去SO2,已知25 ℃,NH3• H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3 × 10-2,Ka2=6.2 × 10-8。若氨水的浓度为2.0 mol/ L,溶液中的c(OH-)约为
25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A.相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) |
| B.在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 |
| C.等物质的量浓度的NaClO和NaHCO3混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO |
根据所学知识回答问题
Ⅰ、常温下,用“酸性”“碱性”“中性”或“不确定”填空。
(1)相同浓度的HCl和NaOH溶液等体积混合。___________ 。
(2)pH=2的HCl和pH=12的NaOH溶液等体积混合。___________ 。
(3)pH=2的HCl和pH=12的NH3·H2O等体积混合。___________ 。
Ⅱ、25 ℃时,部分物质的电离平衡常数如表所示:
(4)上述五种酸的酸性由强到弱的顺序是___________ 。
(5)该温度下,0.10 mol·L-1 HNO2溶液中的c(H+)=___________ mol·L-1。
(6)25 ℃时,向NaClO溶液中通入少量的CO2,发生反应的离子方程式为___________ 。
(7)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___________ (填序号)。
A.升高温度 B.加水稀释 C.加少量CH3COONa固体
D.加入少量冰醋酸 E.加入少量NaOH固体(温度不变)
Ⅰ、常温下,用“酸性”“碱性”“中性”或“不确定”填空。
(1)相同浓度的HCl和NaOH溶液等体积混合。
(2)pH=2的HCl和pH=12的NaOH溶液等体积混合。
(3)pH=2的HCl和pH=12的NH3·H2O等体积混合。
Ⅱ、25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.9×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
H2CO3 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
NH3·H2O | 1.8×10-5 |
(5)该温度下,0.10 mol·L-1 HNO2溶液中的c(H+)=
(6)25 ℃时,向NaClO溶液中通入少量的CO2,发生反应的离子方程式为
(7)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是
A.升高温度 B.加水稀释 C.加少量CH3COONa固体
D.加入少量冰醋酸 E.加入少量NaOH固体(温度不变)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


