解答题-原理综合题 适中0.65 引用2 组卷90
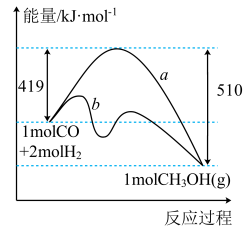
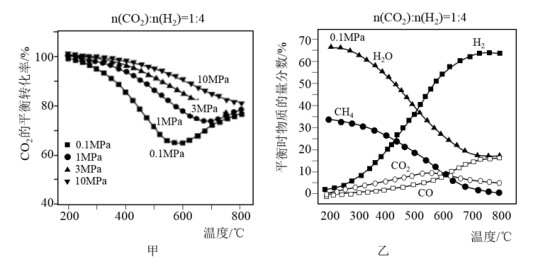
以CO2为原料合成甲烷、甲醇等能源物质具有良好的发展前景。
(1)已知: 2H2(g)+O2(g)= 2H2O(g) ∆H = 483.6kJ·mol-l
CH4(g)+2O2(g)=2H2O(g)+CO2(g) ∆H =- 802.3kJ·mol-1
则反应A:CO2(g)+4H2(g) CH4(g)+2H2O(g)的 ∆H =
CH4(g)+2H2O(g)的 ∆H =_______ , 该反应在_______ ( 填“较高”或“较低”)温度下能自发进行。
(2)将原料气按n(CO2): n(H2)=l: 4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图实线所示(虚线为平衡时的曲线)。
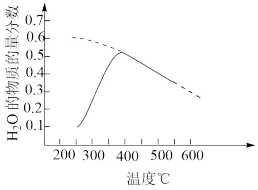
试解释H2O的物质的量分数随温度升高先增大后减小的原因_______ 。
(3)一定条件下发生反应: 3H2(g)+CO2(g) CH3OH(g)+H2O(g), ∆H <0。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2。
CH3OH(g)+H2O(g), ∆H <0。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2。
①下列措施中能使c(CH3OH)增大的是_______ (填字母)
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
②达平衡时,测得容器的总压为1Mpa, CO2的平衡转化率为50%, 计算反应在该温度下的Kp=_______ (保留一位小数。用分压代替浓度代入平衡常数表达式即得Kp)
(1)已知: 2H2(g)+O2(g)= 2H2O(g) ∆H = 483.6kJ·mol-l
CH4(g)+2O2(g)=2H2O(g)+CO2(g) ∆H =- 802.3kJ·mol-1
则反应A:CO2(g)+4H2(g)
(2)将原料气按n(CO2): n(H2)=l: 4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图实线所示(虚线为平衡时的曲线)。
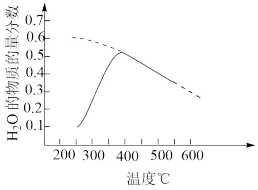
试解释H2O的物质的量分数随温度升高先增大后减小的原因
(3)一定条件下发生反应: 3H2(g)+CO2(g)
①下列措施中能使c(CH3OH)增大的是
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
②达平衡时,测得容器的总压为1Mpa, CO2的平衡转化率为50%, 计算反应在该温度下的Kp=
22-23高二上·浙江杭州·期中
类题推荐
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
I.已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O(l) ΔH2
③H2O(l)=H2O(g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g) CO2(g)+2H2(g)的ΔH=
CO2(g)+2H2(g)的ΔH=___________ 。
II.乙醛蒸气在一定条件下可发生反应:CH3CHO(g) CH4(g)+CO(g) ΔH>0。
CH4(g)+CO(g) ΔH>0。
(1)上述反应正反应速率的表达式为v=kcn(CH3CHO)(k为速率常数,与温度、催化剂有关),测得反应速率与浓度的关系如表所示:
①上述速率表达式中,n=___________ 。
②下列有关说法正确的是___________ (填字母)。
A.升高温度,k增大;加催化剂,k减小
B.升高温度,k减小;加催化剂,k增大
C.降低温度,k减小;加催化剂,k增大
D.降低温度,k增大;加催化剂,k减小。
(2)在一定温度下,向某恒容密闭容器中充入1molCH3CHO(g),在一定条件下反应达到平衡,平衡转化率为a。
①下列情况表明上述反应达到平衡状态的是___________ (填字母)。
A. 保持不变
保持不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.CH4的消耗速率等于CH3CHO的生成速率
②反应达到平衡后,升高温度,容器内压强增大,原因是___________ (从平衡移动角度考虑)。
③若改为恒压密闭容器,其他条件不变,平衡时CH3CHO的转化率为b,则a___________ b(填“>”“=”或“<”)。
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),经过相同时间时测得CH3CHO的转化率与压强的关系如图所示。
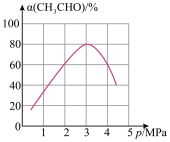
①p>3MPa时,增大压强,CH3CHO的转化率降低,其原因是___________ 。
②当压强为4MPa时,该反应的平衡常数Kp=___________ MPa(用各物质分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
I.已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O(l) ΔH2
③H2O(l)=H2O(g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g)
II.乙醛蒸气在一定条件下可发生反应:CH3CHO(g)
(1)上述反应正反应速率的表达式为v=kcn(CH3CHO)(k为速率常数,与温度、催化剂有关),测得反应速率与浓度的关系如表所示:
| c(CH3CHO)/(mol·L-1) | 0.1 | 0.2 | 0.3 | 0.4 |
| r/(mol·L-1·s-1) | 0.02 | 0.08 | 0.18 | 0.32 |
①上述速率表达式中,n=
②下列有关说法正确的是
A.升高温度,k增大;加催化剂,k减小
B.升高温度,k减小;加催化剂,k增大
C.降低温度,k减小;加催化剂,k增大
D.降低温度,k增大;加催化剂,k减小。
(2)在一定温度下,向某恒容密闭容器中充入1molCH3CHO(g),在一定条件下反应达到平衡,平衡转化率为a。
①下列情况表明上述反应达到平衡状态的是
A.
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.CH4的消耗速率等于CH3CHO的生成速率
②反应达到平衡后,升高温度,容器内压强增大,原因是
③若改为恒压密闭容器,其他条件不变,平衡时CH3CHO的转化率为b,则a
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),经过相同时间时测得CH3CHO的转化率与压强的关系如图所示。

①p>3MPa时,增大压强,CH3CHO的转化率降低,其原因是
②当压强为4MPa时,该反应的平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网