解答题-原理综合题 适中0.65 引用1 组卷119
我国明确提出2030年“碳达峰”与2060年“碳中和”目标,“碳中和”对我国意味着:一是能源转型首当其冲;二是通过工艺改造、节能等措施减少二氧化碳的排放在能源的产生、转换、消费过程。减少二氧化碳排放的方法之一是将CO2催化还原,比如:
反应1: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
反应2: CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
都是目前处理CO2的重要方法。回答下列问题:
(1)反应1在_______ 的条件下能自发发生。(填低温、高温、任意温度)
(2)已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1
②H2O(1)=H2O(g) ΔH3=44.0 kJ·mol-1,
则 ΔH2=_______ kJ·mol-1。
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1达到平衡,下列有关叙述正确的是_______。
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1达到平衡,下列有关叙述正确的是_______。
(4)一定条件下,在1L密闭容器中加入2molCO2和2molH2只发生反应2: CO2(g)+H2(g)  CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入lmolCO2, t2时刻到达新的平衡。
CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入lmolCO2, t2时刻到达新的平衡。
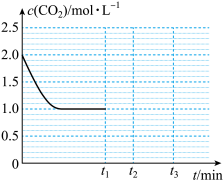
请你画出t1~t3内时刻CO2的物质的量浓度随时间改变的变化图:______
反应1: CO2(g)+3H2(g)
反应2: CO2(g)+H2(g)
都是目前处理CO2的重要方法。回答下列问题:
(1)反应1在
(2)已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1
②H2O(1)=H2O(g) ΔH3=44.0 kJ·mol-1,
则 ΔH2=
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2发生反应:CO2(g)+3H2(g)
| A.升高温度,逆反应速率增加,平衡常数减小 |
| B.再加入一定量的CO2和H2, CO2和H2的转化率不可能同时都增大 |
| C.加入合适的催化剂可以提高CO2的平衡转化率 |
| D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量 |

请你画出t1~t3内时刻CO2的物质的量浓度随时间改变的变化图:
22-23高二上·浙江杭州·期中
类题推荐
我国明确提出2060年“碳中和”目标,意味着需要通过工艺改造、节能等措施减少在能源的产生、转换、消费过程中二氧化碳的排放。回答下列问题:
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行:
反应①:CH4(g) C(ads)+2H2(g)
C(ads)+2H2(g)
反应②:C(ads)+CO2(g) 2CO(g)。
2CO(g)。
上述反应中C(ads)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图1所示。
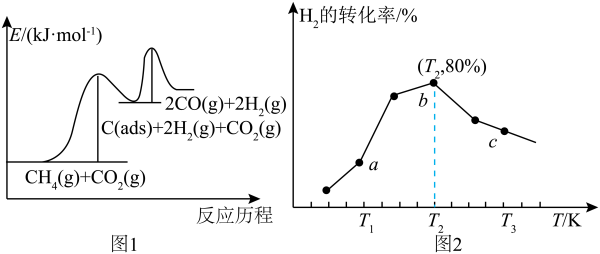
(1)总反应CH4(g)+CO2(g) 2H2(g)+2CO(g))能自发进行的条件为
2H2(g)+2CO(g))能自发进行的条件为___________ ;研究表明,总反应速率由反应①决定,请结合图1与碰撞理论说明原因:______ 。
Ⅱ.将C催化还原,是目前处理CO2的重要方法。
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1<0
CH3OH(g)+H2O(g) ΔH1<0
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(2)已知CO和H2的燃烧热分别为-283kJ·mol-1和-285.8kJ·mol-1,H2O(1)=H2O(g) ΔH3=+44kJ·mol-1,则ΔH2=___________ kJ·mol-1
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2,发生反应i达到平衡,下列有关叙述正确的是___________(填标号)。
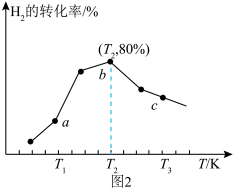
(4)在一定条件下,向1L恒容密闭容器中充入2molCO2和6molH2,发生反应i,测得在相同时间内,不同温度下H2的转化率如图2所示,T2时,若起始压强为10atm,则Kp=___________ atm-2(结果保留一位小数,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅲ.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图3所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气体匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图4所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
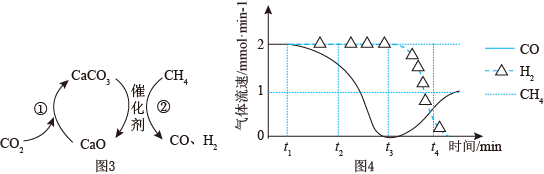
(5)t1~t3,n(H2)比n(CO)多,可能发生副反应的化学方程式为___________ 。
(6)t2后CO、CH4流速如图4变化的原因可能是___________ 。
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行:
反应①:CH4(g)
反应②:C(ads)+CO2(g)
上述反应中C(ads)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图1所示。

(1)总反应CH4(g)+CO2(g)
Ⅱ.将C催化还原,是目前处理CO2的重要方法。
i.CO2(g)+3H2(g)
ii.CO2(g)+H2(g)
(2)已知CO和H2的燃烧热分别为-283kJ·mol-1和-285.8kJ·mol-1,H2O(1)=H2O(g) ΔH3=+44kJ·mol-1,则ΔH2=
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2,发生反应i达到平衡,下列有关叙述正确的是___________(填标号)。
| A.升高温度,逆反应速率增加,平衡常数减小 |
| B.按相同比例再加入一定量的CO2和H2,CO2和H2的转化率同时增大 |
| C.加入合适的催化剂可提高CO2的平衡转化率 |
| D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量 |
Ⅲ.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图3所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气体匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图4所示。反应过程中始终未检测到CO2,在催化剂上有积碳。

(5)t1~t3,n(H2)比n(CO)多,可能发生副反应的化学方程式为
(6)t2后CO、CH4流速如图4变化的原因可能是
我国明确提出2060年“碳中和”目标,意味着需要通过工艺改造、节能等措施减少在能源的产生、转换、消费过程中二氧化碳的排放。回答下列问题:
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行:
反应A:CH4(g) C(ads)+2H2(g);反应B:C(ads)+CO2(g)
C(ads)+2H2(g);反应B:C(ads)+CO2(g) 2CO(g)
2CO(g)
上述反应中C(ads)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图1所示。
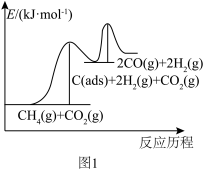
(1)总反应CH4(g)+CO2(g) 2H2(g)+2CO(g))能自发进行的条件为
2H2(g)+2CO(g))能自发进行的条件为_____ (填“高温”或“低温”);总反应速率由反应_____ 决定(填“A”或“B”)。
Ⅱ.将C催化还原,是目前处理CO2的重要方法。
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1<0
CH3OH(g)+H2O(g) ΔH1<0
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(2)已知CO和H2的燃烧热分别为-283kJ·mol-1和-285.8kJ·mol-1,H2O(1)=H2O(g) ΔH3=+44kJ·mol-1,则ΔH2=_____ kJ·mol-1
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2,发生反应i达到平衡,下列有关叙述正确的是_____(填标号)。
(4)在一定条件下,向1L恒容密闭容器中充入2molCO2和6molH2,发生反应i,测得在相同时间内,不同温度下H2的转化率如图2所示,T2时,若起始压强为10atm,则Kp=_____ atm-2(结果保留一位小数,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅲ.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图3所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气体匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图4所示。反应过程中始终未检测到CO2,检测到催化剂上有积碳。
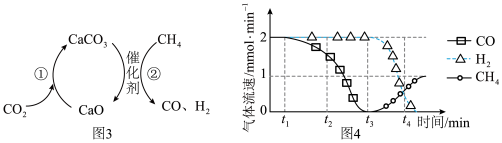
(5)t1~t3,n(H2)比n(CO)多,可能发生副反应的化学方程式为_____ 。
(6)t2后CO、CH4流速如图4变化的原因可能是_____ 。
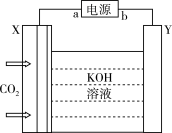
(7)用如图装置模拟科学研究在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应),X极上的电极反应式为_____ 。
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行:
反应A:CH4(g)
上述反应中C(ads)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图1所示。

(1)总反应CH4(g)+CO2(g)
Ⅱ.将C催化还原,是目前处理CO2的重要方法。
i.CO2(g)+3H2(g)
ii.CO2(g)+H2(g)
(2)已知CO和H2的燃烧热分别为-283kJ·mol-1和-285.8kJ·mol-1,H2O(1)=H2O(g) ΔH3=+44kJ·mol-1,则ΔH2=
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2,发生反应i达到平衡,下列有关叙述正确的是_____(填标号)。
| A.升高温度,逆反应速率增加,平衡常数减小 |
| B.按相同比例再加入一定量的CO2和H2,CO2和H2的转化率同时增大 |
| C.加入合适的催化剂可提高CO2的平衡转化率 |
| D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量 |
(4)在一定条件下,向1L恒容密闭容器中充入2molCO2和6molH2,发生反应i,测得在相同时间内,不同温度下H2的转化率如图2所示,T2时,若起始压强为10atm,则Kp=

Ⅲ.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图3所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气体匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图4所示。反应过程中始终未检测到CO2,检测到催化剂上有积碳。

(5)t1~t3,n(H2)比n(CO)多,可能发生副反应的化学方程式为
(6)t2后CO、CH4流速如图4变化的原因可能是
(7)用如图装置模拟科学研究在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应),X极上的电极反应式为

甲醚(CH3OCH3)是一种重要的新型能源,用CO和H2合成甲醚的有关反应如下:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1;
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1;
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41 kJ·mol-1。
回答下列问题:
(1)3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g) ΔH=_____ kJ·mol-1。
(2)下列措施能提高反应CO(g)+H2O(g)⇌CO2(g)+H2(g)中CO平衡转化率的有_____ (填序号)。
A.使用高效催化剂 B.增加H2O(g)的浓度 C.增大压强 D.升高温度
(3)下列叙述中能说明反应3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g)处于平衡状态的是_______ (填序号)。
A.生成3 mol H—H键的同时生成6 mol C—H键
B.混合气体的总物质的量不变
C.正逆反应速率相等,且都等于零
D.二氧化碳和甲醚的物质的量相等
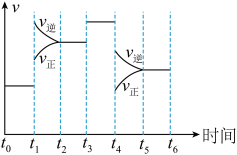
(4)如图为反应CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1达到平衡后,在t1、t3、t4时刻改变某一条件反应速率随时间的变化曲线图。t4时改变的条件是______ ;在t1~t6时间段内,CH3OH物质的量分数最少的一段时间是______ 。
(5)对于反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1,在T℃时,向体积不变的密闭容器中投入一定量CH3OH气体,气体混合物中CH3OCH3的物质的量分数φ(CH3OCH3)与反应时间t的关系如表所示:
①30 min时,CH3OH的转化率为_____ ;根据表中数据,T℃时,该反应的平衡常数为_____ 。
②上述反应中,反应速率v=v正-v逆=k正φ2(CH3OH)-k逆φ(CH3OCH3)·φ(H2O),k正和k逆分别为正向、逆向反应速率常数,φ为物质的量分数。计算15 min时 =
=________ (结果保留2位小数)。
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1;
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1;
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41 kJ·mol-1。
回答下列问题:
(1)3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g) ΔH=
(2)下列措施能提高反应CO(g)+H2O(g)⇌CO2(g)+H2(g)中CO平衡转化率的有
A.使用高效催化剂 B.增加H2O(g)的浓度 C.增大压强 D.升高温度
(3)下列叙述中能说明反应3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g)处于平衡状态的是
A.生成3 mol H—H键的同时生成6 mol C—H键
B.混合气体的总物质的量不变
C.正逆反应速率相等,且都等于零
D.二氧化碳和甲醚的物质的量相等
(4)如图为反应CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1达到平衡后,在t1、t3、t4时刻改变某一条件反应速率随时间的变化曲线图。t4时改变的条件是

(5)对于反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1,在T℃时,向体积不变的密闭容器中投入一定量CH3OH气体,气体混合物中CH3OCH3的物质的量分数φ(CH3OCH3)与反应时间t的关系如表所示:
| t/min | 0 | 15 | 30 | 45 | 80 | 100 |
| φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
②上述反应中,反应速率v=v正-v逆=k正φ2(CH3OH)-k逆φ(CH3OCH3)·φ(H2O),k正和k逆分别为正向、逆向反应速率常数,φ为物质的量分数。计算15 min时
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


