解答题-实验探究题 适中0.65 引用1 组卷231
自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
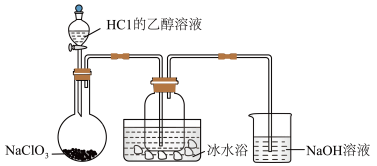
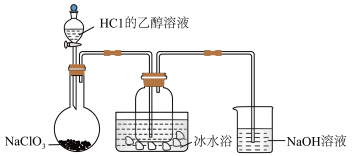
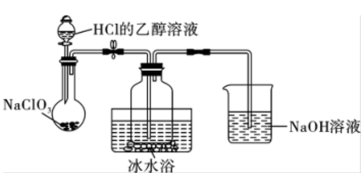
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
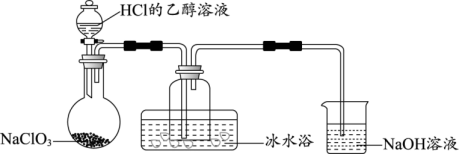
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3+4HCl= 2ClO2↑+Cl2↑+ 2NaCl+2H2O。
① 冰水浴的作用是_______ 。
② NaOH溶液中发生的主要反应的离子方程式为_______ 。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量淀粉溶液,观察到__ ,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl- 除去。下列试剂中,可将ClO
),需将其转化为Cl- 除去。下列试剂中,可将ClO 转化为Cl-的是____(填字母序号)。
转化为Cl-的是____(填字母序号)。
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。上述制备K2FeO4反应的离子方程式为___ 。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。

资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3+4HCl= 2ClO2↑+Cl2↑+ 2NaCl+2H2O。
① 冰水浴的作用是
② NaOH溶液中发生的主要反应的离子方程式为
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量淀粉溶液,观察到
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
| A.FeSO4 | B.O3 | C.KMnO4 | D.SO2 |
20-21高一上·北京海淀·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网