解答题-实验探究题 适中0.65 引用2 组卷198
工业常用浓硝酸、浓硫酸吸收工业废气中的 、
、 生成亚硝基硫酸(
生成亚硝基硫酸( )来消除污染。亚硝基硫酸(
)来消除污染。亚硝基硫酸( )常温下是颗粒状晶体,在水溶液中难电离。某兴趣小组为了验证该方法的可行性,进行如下实验:
)常温下是颗粒状晶体,在水溶液中难电离。某兴趣小组为了验证该方法的可行性,进行如下实验:
(1) 制备方法一
制备方法一
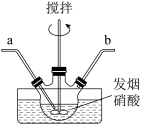
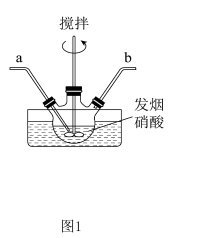
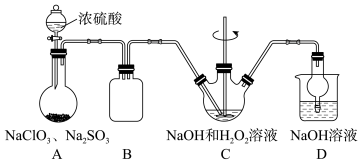
反应原理: 。实验装置如图所示。
。实验装置如图所示。_______ ,为了尽可能使气体反应充分,应控制a、b处通入气体流速的比值为_______ 。
(2) 制备方法二
制备方法二
反应原理: 。请补充完整由混有少量NaCl的
。请补充完整由混有少量NaCl的 固体制备较纯净的
固体制备较纯净的 晶体的实验方案:向混有少量NaCl的
晶体的实验方案:向混有少量NaCl的 固体中加入
固体中加入_______ ,将制得的较纯净二氧化硫气体通入浓硝酸中充分反应并_______ ,将反应后的溶液过滤、洗涤、干燥。(可选用的试剂有: 溶液、
溶液、 溶液、
溶液、 饱和溶液、NaOH溶液)
饱和溶液、NaOH溶液)
(3)测定 产品纯度:
产品纯度:
准确称取0.7000g产品于锥形瓶中,加入少量硫酸溶解,再加入 溶液40.00mL,摇匀,用
溶液40.00mL,摇匀,用 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液的体积为20.00mL。已知:
标准溶液的体积为20.00mL。已知: ;
; 中的氮元素能被
中的氮元素能被 氧化为硝酸。
氧化为硝酸。
①写出 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
②计算 产品的纯度(写出计算过程)。
产品的纯度(写出计算过程)。_______
(1)
反应原理:
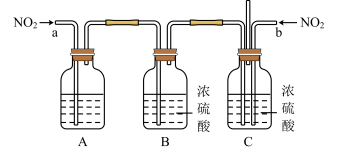
(2)
反应原理:
(3)测定
准确称取0.7000g产品于锥形瓶中,加入少量硫酸溶解,再加入
①写出
②计算
22-23高三上·江苏南通·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网